
【题目】痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq) ![]() Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
②NaUr(s) ![]() Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp______(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是_______(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为_________。
【答案】 Ksp=6.4×10-5 减小 放热 1.33×10-6mol/L
【解析】试题分析:(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp=c(Na+)·c(Ur―)= 8.0×10-3mol/L×8.0×10-3mol/L=6.4×10-5mol2/L2;(2)由于关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp减小,降低温度,平衡逆向移动。根据平衡移动原理:降低温度,平衡向放热反应方向移动,所以生成尿酸钠晶体的反应是放热反应;(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,则尿酸根离子的浓度是2.0×10-3mol/L-5.0×10-4mol/L=1.5×10-3mol/L,37℃时,Ka =4.0×10-6= [c(H+)·c(Ur-)]÷c(HUr),所以该病人尿液的c(H+) =[Ka·c(HUr)]÷c(Ur-)=[4.0×10-6×5.0×10-4] ÷1.5×10-3=1.33×10-6mol/L。


科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸钠在水溶液中会发生如下反应:CH3COONa+H2OCH3COOH+NaOH,下列图示能表示该反应过程中能量变化的是( )
A.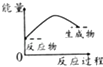
B.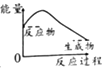
C.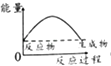
D.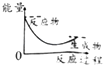
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。下列有关说法正确的是
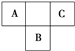
A. A、C的氢化物的沸点都是同族元素中最低的
B. 三种元素的最高化合价分别与其主族序数相等
C. 原子半径:B >A>C
D. 非金属性:C>B,C单质能从B的氢化物水溶液中置换出B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
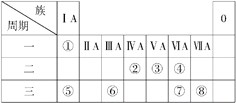
Ⅰ.(1)请画出元素⑧的离子结构示意图: _______________。
(2)⑦和⑧的最高价氧化物对应水化物的酸性强弱为______>______(填化学式)。
(3)④⑤两种元素的原子按1∶1组成的常见化合物的电子式为________。
Ⅱ.常见物质A、B、C均含有表中①~⑧中的一种或几种元素,可发生以下反应(副产物已略去),试回答:
![]()
![]()
![]()
![]()
![]()
(1)若X是强氧化性单质,则A可能是______ (填序号)。
a.S b.Na c.Al d.NH3 e.CH4
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀。写出反应②的化学方程式: ____________________。
(3)若A、B、C为含有同一金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,写出A与C两溶液反应的离子方程式: _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2 , 可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( ) 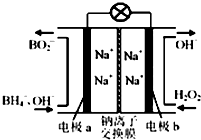
A.电池放电时Na+从a极区移向b极区
B.电极a采用MnO2 , 放电时它被还原
C.该电池负极的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D.放电时,a极区的电极反应生成碱,碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,分子式为C2H4 , A进行下图1所示的转化可制得有果香味的液体E(C4H8O2),回答下列问题: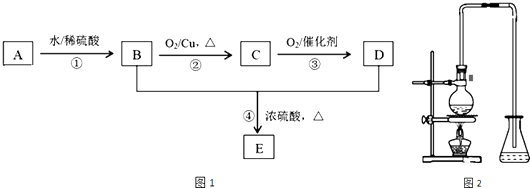
(1)A的结构简式为 , B中所含官能团的名称为 .
(2)①④反应的类型分别是、 .
(3)反应②的化学方程式为
(4)E的名称为 . 实验室由反应④制备E的装置如图2,烧杯中加入碎瓷片的作用是 , 长导管的作用是导气和 , 锥形瓶中盛放的液体是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com