
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2 , 可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( ) 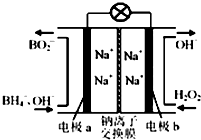
A.电池放电时Na+从a极区移向b极区
B.电极a采用MnO2 , 放电时它被还原
C.该电池负极的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D.放电时,a极区的电极反应生成碱,碱性增强
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+)

常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)2HN3(g),并达到化学平衡,根据表中数据回答有关问题
物质的量浓度 | N2 | H2 | NH3 |
起始/molL﹣1 | a | 6 | 0 |
转化/molL﹣1 | b | c | d |
平衡/molL﹣1 | 1 | e | 3 |
(1)表中a= , e=
(2)若反应经3min达到平衡,则反应速率v(N2)=molL﹣1min﹣1;
(3)该反应体系的起始状态与平衡状态的压强之比为;
(4)上述反应过程中,如果降低温度,则反应速度(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq) ![]() Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
②NaUr(s) ![]() Ur-(aq)+Na+(aq)
Ur-(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp______(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是_______(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
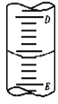
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是

A. 甲、乙两烧杯中溶液的pH均保持不变
B. 甲烧杯中a的电极反应式为:4OH-―4e-=O2↑+2H2O
C. 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀
D. 当b极增重3.2g时,d极产生的气体为2.24L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和钠的化合物是重要的无机物。
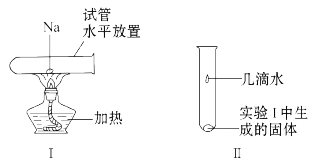
(1)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为____________,检验该反应产生的气体的方法是________________。
(2)铯与钠同主族,对于铯及其化合物性质的推断正确的是_________________________(填序号)。
①铯的熔点比钠的高 ②铯与氧气反应只生成Se2O ③SeOH的碱性比KOH强 ④铯不能从FeCl3溶液中置换出铁 ⑤SeCl的水溶液显中性
(3)某无色稀溶液中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH![]() 中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
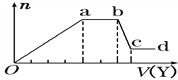
则X中一定含有的阳离子是______________________________,ab段反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.4OH--4e-=2H2O+O2↑B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH-D.Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li3N是一种储氢材料,可以用Li和N2在450℃反应制备。已知Li3N易水解,细粉状的Li3N在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。请回答下列问题:
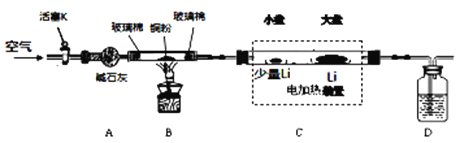
(1)B装置的作用是_________________,如果B装置中玻璃管两端没有玻璃棉可能造成的后果是____________________________。
(2)D装置中的试剂是_____________,作用是__________________________。
(3)C装置的小盘中放有少量Li的作用是____________________________。
(4)实验步骤如下:安装好仪器,检查装置气密性,装入药品;_________________________。(请按正确的顺序填入下列步骤的标号);拆除装置,取出产物。
①点燃B中酒精灯加热B中试管;
②打开活塞K;
③关闭电加热装置停,充分冷却;
④调节电加热装置控制温度为450℃;
⑤关闭活塞K;
⑥熄灭B中酒精灯;
(5)请你设计一个实验,用化学方法区分Li与Li3N,写出实验简要步骤及观察到的现象___________________________________。
(6)Li3N在H2中加热时可得到氨基锂(LiNH2),该反应在270℃可逆,所以Li3N可作为储氢材料,该反应的化学方程式为:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com