
【题目】恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)2HN3(g),并达到化学平衡,根据表中数据回答有关问题
物质的量浓度 | N2 | H2 | NH3 |
起始/molL﹣1 | a | 6 | 0 |
转化/molL﹣1 | b | c | d |
平衡/molL﹣1 | 1 | e | 3 |
(1)表中a= , e=
(2)若反应经3min达到平衡,则反应速率v(N2)=molL﹣1min﹣1;
(3)该反应体系的起始状态与平衡状态的压强之比为;
(4)上述反应过程中,如果降低温度,则反应速度(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
【答案】
(1)2.5;1.5
(2)0.5
(3)17:11
(4)减小
(5)BCD
【解析】解:利用三段式列式计算,
N2 | + | 3H2 | 2NH3 | ||
起始(mol/L) | 2.5 | 6 | 0 | ||
转化(mol/L) | 1.5 | 4.5 | 3 | ||
平衡(mol/L) | 1 | 1.5 | 3 |
(1.)所以对比表中的相关数据可知a=2.5,e=1.5,所以答案是:2.5;1.5;
(2.)根据v= ![]() 可计算出v(N2)=
可计算出v(N2)= ![]() =0.5mol/(L.min),所以答案是:0.5mol/(L.min);
=0.5mol/(L.min),所以答案是:0.5mol/(L.min);
(3.)该体系在起始时总浓度为2.5mol/L+6mol/L=8.5mol/L,平衡后的总浓度为1mol/L+1.5mol/L+3mol/L=5.5mol/L,根据压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,可知起始状态和平衡状态的压强比为8.5:5.5=17:11,所以答案是:17:11;
(4.)影响反应速率的因素分析,降低温度反应速率减小,所以答案是:减小;
(5.)A.气体质量和体积不变,无论该反应是否达到平衡状态,容器内密度始终不变,所以混合气体的密度不再变化不能判断平衡状态,故A错误;
B.该反应是一个反应前后气体体积减小的可逆反应,当容器内压强保持不变时,正逆反应速率相等,反应达到平衡状态,混合气体的压强不再变化说明反应达到平衡状态,故B正确;
C.N2的正反应速率等于逆反应速率,反 应达到平衡状态,故C正确;
D.N2的浓度保持恒定不变是反应达到平衡的标志,故D正确;
所以答案是:BCD.
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡的计算,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】有a、b、c三种金属,将a、c分别投入相同浓度的盐酸中,c比a反应剧烈,将铜分别浸入a和b的盐溶液里,只有单质b析出。则三种金属的活动性由强到弱的顺序是
A. c、a、b B. b、a、c C. c、b、a D. a、b、c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述不正确的是( )
A.中和滴定接近终点时,滴入要慢,并且不断摇动
B.向试管中滴加溶液时,滴管尖嘴紧贴试管内壁
C.分液时,下层液体下口放出,上层液体上口倒出
D.定容时,加水到容量瓶刻度线下1~2cm时,改用胶头滴管加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸钠在水溶液中会发生如下反应:CH3COONa+H2OCH3COOH+NaOH,下列图示能表示该反应过程中能量变化的是( )
A.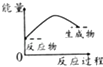
B.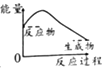
C.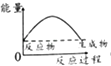
D.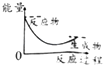
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,总反应:
2Cu+H2O![]() Cu2O+H2
Cu2O+H2![]() 。下列说法正确的是
。下列说法正确的是

A. 石墨电极发生氧化反应
B. 铜电极发生的电极反应式:2Cu-2e- + H2O==Cu2O+2H+
C. 电解后溶液的PH减小
D. 当有0.1mol电子转移时,有0.05 molCu2O生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。下列有关说法正确的是
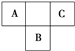
A. A、C的氢化物的沸点都是同族元素中最低的
B. 三种元素的最高化合价分别与其主族序数相等
C. 原子半径:B >A>C
D. 非金属性:C>B,C单质能从B的氢化物水溶液中置换出B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2 , 可用作空军通信卫星电源,其工作原理如图所示,下列说法正确的是( ) 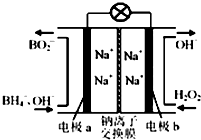
A.电池放电时Na+从a极区移向b极区
B.电极a采用MnO2 , 放电时它被还原
C.该电池负极的电极反应式为:BH4﹣+8OH﹣﹣8e﹣═BO2﹣+6H2O
D.放电时,a极区的电极反应生成碱,碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299K时,合成氨反应 N2(g)+3H2(g)2NH3(g)△H=﹣92.0kJ/mol,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
A.一定大于92.0kJ
B.一定等于92.0kJ
C.一定小于92.0kJ
D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com