
近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质——碳纳米颗粒.这种碳纳米颗粒可用氧化法提纯.其反应的化学方程式为:
□C+□K2Cr2O7+□H2SO4(稀)![]() □CO2+□K2SO4+□Cr2(SO4)3+□________
□CO2+□K2SO4+□Cr2(SO4)3+□________
(1)完成并配平上述反应的化学方程式.
(2)此反应的氧化剂是________,氧化产物是________.
(3)H2SO4在上述反应中表现出来的性质是________.
A.酸性
B.氧化性
C.吸水性
D.脱水性
(4)上述反应中若产生11 g气体物质,则转移的电子数目为________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,我国储氢纳米碳管研究获得重大进展,电弧法合成的碳纳米管,常伴有大量的物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法除去,同时生成的产物对环境不会产生污染。在整个反应体系中除了碳单质外,还有K2Cr2O7 、K2SO4、Cr2(SO4)3、H2SO4、H2O和X。
(1)根据题意,可判断出X是____________(写化学式)。
(2)在反应中,氧化剂应是____________(写化学式),硫酸的作用是_____________。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目。
(4)在上述反应中,若产生22 g X物质,则反应中转移的电子数目为_____________。![]()
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邯郸市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暧,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C+___K2Cr2O7+___—___CO2↑+ ___K2SO4+ ___Cr2(SO4)3+___H2O
①完成并配平上述化学方程式。
②在上述方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式________
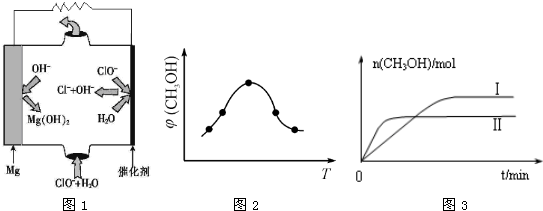
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为_____________________。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)(g)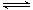 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①该反应的平衡常数表达式为K_______。
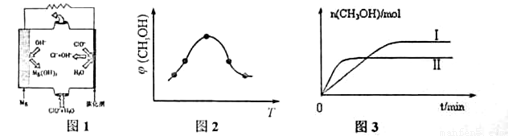
②取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数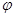 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0
(填 “>”、“<”或“
=” )。
③在同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线 I、II对应的平衡常数大小关系为KI_______KII (填“>”、“<”或“ = ”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com