
���������ҹ���������̼���о�����ش��չ���绡���ϳɵ�̼���ܣ������д��������ʡ���̼������������̼����������������������ȥ��ͬʱ���ɵIJ���Ի������������Ⱦ����������Ӧ��ϵ�г���̼�����⣬����K2Cr2O7 ��K2SO4��Cr2(SO4)3��H2SO4��H2O��X��
��1���������⣬���жϳ�X��____________��д��ѧʽ����
��2���ڷ�Ӧ�У�������Ӧ��____________��д��ѧʽ���������������_____________��
��3��д������ƽ�÷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ��
��4����������Ӧ�У�������22 g X���ʣ���Ӧ��ת�Ƶĵ�����ĿΪ_____________��![]()

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
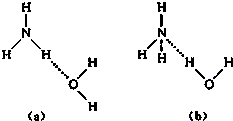 ��������
������и��� NH4++OH-�����ж�NH3����ˮ���γ�NH3?H2O�ĺ����ṹ��
NH4++OH-�����ж�NH3����ˮ���γ�NH3?H2O�ĺ����ṹ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
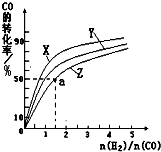
| �¶� | 250�� | 300�� | 350�� |
| K | 2.0 | 0.27 | 0.012 |
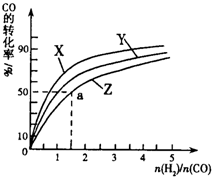
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
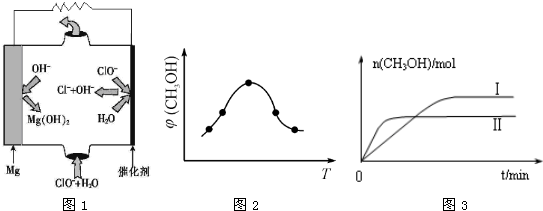
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
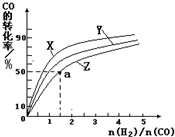
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com