
| A、氯化氢 | B、溴水 |
| C、氯气 | D、碘的酒精溶液 |
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
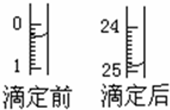 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 24.95 | 24.45 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.55 | 24.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HBr |
| B、HCl |
| C、H2 |
| D、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W | 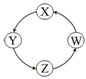 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁 |
| B、分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 |
| C、红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐 |
| D、针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| D、NaHCO3溶液:c(Na+)+c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-o |
| 键能(Kj/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的颜色变浅 |
| B、混合气体的物质的量相等 |
| C、混合气中NO2、NO、O2物质的量之比为2:2:1 |
| D、单位时间内生成2nmolNO同时生成2nmolNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com