
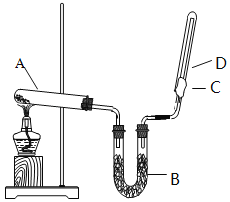
【题目】如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)B处的药品是_____(填“浓硫酸”或“碱石灰”)
(2)检验D处试管中NH3是否收集满,可以用湿润的_____色石蕊试纸(填“红”或“蓝”)。
(3)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为_____。
(4)A处反应的化学方程式是_____。
四、推断题
【答案】碱石灰 红 0.1mol/L 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
(1)制备的氨气中含有水蒸气,需要用碱石灰吸收;
(2)氨气是碱性气体需要用湿润的红色石蕊试纸验满;
(3)根据![]() 进行计算;
进行计算;
(4)实验室制备氨气的原理是利用固体氯化铵和氢氧化钙加热反应生成。
(1)装置图分析可知,生成的氨气中含有水蒸气,氨气是碱性气体需要通过碱石灰吸收水蒸气,对氨气进行干燥;故答案为:碱石灰;
(2)氨气是碱性气体需要用湿润的红色石蕊试纸验满;故答案为:红;
(3)2.24 L的氨气的物质的量为0.1mol,c=![]() =
=![]() =0.1mol/L;
=0.1mol/L;
(4)A处发生反应是实验室制备氨气的反应,利用氢氧化钙和氯化铵加热反应生成氨气,反应的化学方程式2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低
C.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b
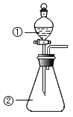
D.用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)仪器A的名称是_____。
(2)A的材质不能用铁质的代替,其原因是:_____。
(3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是:____。实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),若实验操作均正确,则所求中和热___(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_____。
(5)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略)。请回答:
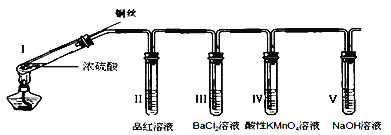
(1)下列说法正确的是__________。
A.反应后,将试管Ⅰ中的白色固体加入水中,溶液呈蓝色
B.取下试管Ⅲ并不断振荡,试管中出现浑浊,是因为生成了BaSO4
C.试管Ⅳ中KMnO4溶液褪色,说明SO2具有氧化性
D.试管V中的NaOH溶液可用Na2CO3溶液代替
(2)取下试管Ⅱ,在该试管口套上气球,将无色溶液加热恢复至红色,冷却后,发现溶液颜色再次变浅。解释“无色→红色→颜色变浅”变化的原因______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为_____。
(2)把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体J的合成路线如下。
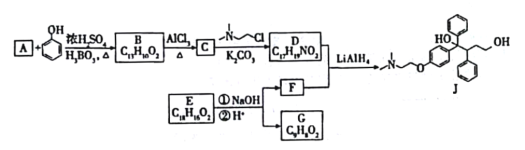
已知:
i.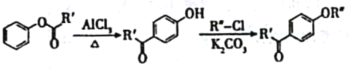
ii.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐,其名称为_______________.
(2)C中含有的官能团为______________________________(填名称)。
(3)C→D的化学反应方程式为_________________________,反应类型为______________________。
(4)E是一种天然香料,经碱性水解、酸化,得F和G。G经还原可转化为F。G的结构简式为________________________________。
(5)K是G的同分异构体,符合下列条件的K的结构简式是_____________________。(任意写一种)
①包含2个六元环
②K可水解,与NaOH溶液供热时,1molK消耗1molNaOH
(6)推测D和F反应得到J的过程中,反应物LiAIH4的作用是_________________。
(7)由J合成托瑞米芬的古城:
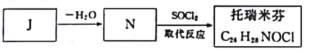
托瑞米芬具有反应结构,其结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com