
【题目】用50mL0.50mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)仪器A的名称是_____。
(2)A的材质不能用铁质的代替,其原因是:_____。
(3)实验时氢氧化钠溶液的浓度要用0.55mol·L-1的原因是:____。实验中若改用60mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),若实验操作均正确,则所求中和热___(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1molH2O时,放出57.3kJ的热量,则上述反应的热化学方程式为:_____。
(5)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果_____(填“有”或“无”)影响。
【答案】环形玻璃搅拌棒 金属铁易导热,容易造成热量的散失,引起较大的实验误差 保证0.50mol/L的盐酸完全被NaOH中和 不相等 相等 HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol 无 有
【解析】
(1)根据仪器的结构判断其名称;
(2)根据金属棒是热的良导体,易传热,中和热测定实验成败的关键是保温工作;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据物质的量与热量的关系以及中和热的概念,书写相应的热化学方程式;
(5)根据反应实质、物质结构分析判断。
(1)根据装置图可知仪器A的名称是环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,减少实验过程中的热量损失,铁棒导热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,导致产生较大误差;
(3)用过量的氢氧化钠溶液就可以保证50mL0.50molL-1盐酸完全反应,以盐酸的量为准进行准确计算;反应放出的热量和所用酸以及碱的量的多少有关,若用60mL 0.50molL-1的盐酸与50mL0.55molL-1的氢氧化钠溶液进行反应,由于反应产生的水多,所以与上述实验相比,所放出的热量偏高,但由于中和热是强酸和强碱反应生成1mol水时放出的热,因此与发生反应的酸、碱的用量无关,中和热相等;
(4)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol;
(5) KOH、NaOH都是一元强碱,在溶液中完全电离产生自由移动的离子,因此若用KOH代替NaOH,对测定结果无影响;若用醋酸代替HCl做实验,由于醋酸是弱酸,醋酸电离是吸热的过程,使反应放出的热量减少,导致实验测得中和热的数值偏小,因此对测定结果有影响。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
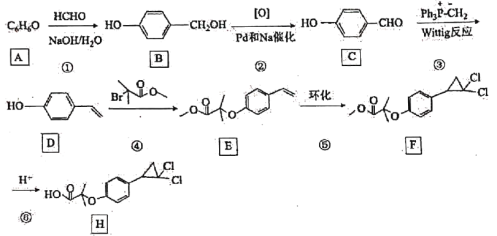
回答下列问题:
(1)B的化学名称为___________。
(2)F中非含氧官能团的名称为___________。
(3)反应①的反应类型为___________,反应④的化学方程式为_______________________。
(4)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有____种(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为___________。
(5)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:____________________________________________。
的合成路线:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛.
(1)根据如图写出合成氨的热化学方程式是____________________.

(2)将1mol N2(g)和3mol H2(g)放在一密闭容器中,进行反应,测得反应放出的热量______(填“大于”、“等于”或“小于”)92.2kJ,原因是______;若加入催化剂,△H__________(填“变大”、“不变”或“变小”).
(3)N2H4可视为NH3分子中的H被﹣NH2取代的产物.发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g).
已知:N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=﹣534kJmol﹣1
则1mol N2H4与NO2完全反应的热化学方程式为______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4,按下列步骤实验。
①将该固体溶于水得无色溶液。
②向溶液中加入AgNO3溶液,得到白色沉淀,再加足量的稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。根据上述现象判断:
(1)一定存在的物质是_______;一定不存在的物质是________;可能存在的物质是_____________;
(2)请写出白色沉淀部分溶解的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,实验室用NH4Cl和Ca(OH)2制取NH3。试回答下列问题:
(1)B处的药品是_____(填“浓硫酸”或“碱石灰”)
(2)检验D处试管中NH3是否收集满,可以用湿润的_____色石蕊试纸(填“红”或“蓝”)。
(3)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为_____。
(4)A处反应的化学方程式是_____。
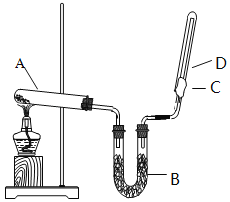
四、推断题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中加入一定量的A(s)和B(g),进行如下可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
A. ①⑤B. ③⑤C. ②④D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃下,在一容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) 。下列各物理量随反应时间变化趋势的曲线不正确的是
CH3OH(g) 。下列各物理量随反应时间变化趋势的曲线不正确的是
A. 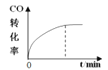 B.
B. 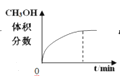
C. 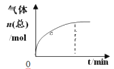 D.
D. 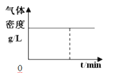
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com