
����Ŀ�������Ͻ���������й㷺Ӧ�ã�ij��ȤС��Ϊ���÷����������Ͻ����������ʵ�������Ʊ��ۺ���������������
��1���ۺ���������һ����������ѧ�����ȶ�������ˮ���ܵ������������������Ҵ�������ѧʽ�ɱ�ʾΪ[Fe2(OH)x(SO4)y]n��
�پۺ������������ھ�ˮ��ԭ���� ��
��������Ϊ���������еġ���������ƴ���ȱ�ݣ�������Ľ������ ��Ũ��ʱ�����м���һ�������Ҵ��������Ҵ���Ŀ���� ��
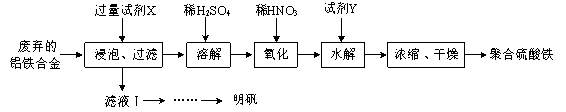
�ۼ����Լ�Y��Ŀ���ǵ���pH�������Լ�YΪ ����Һ��pH��[Fe2(OH)x(SO4)y]n ��x��ֵ�нϴ�Ӱ�죨��ͼ1��ʾ�����Է���pH��С��pH��3�����¾ۺ���������x��ֵ��С��ԭ�� ��
��2��������һ�ֳ������������Ρ�
��Ϊ�������ԭ�ϣ� �Լ�XӦΪ ��
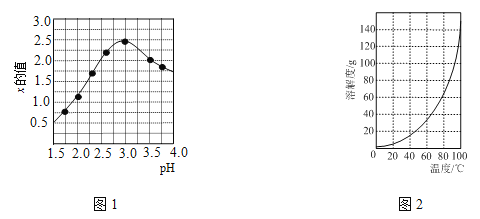
������ͼ2��ʾ�������ܽ�����ߣ�������������Һ���Ʊ����������ʵ�鲽��(��ѡ�õ��Լ��������������Ͻ�ϡ���ᡢNaOH��Һ�;ƾ�)������Һ���м��������ĺ�������м�����������ݲ��������ˣ� ������Һ �� �����ˡ����þƾ�ϴ�ӡ�������յõ��������塣
���𰸡���1�����ۺ�����������������������ϡHNO3��ΪH2O2����O2��O3�������;ۺ����������ܽ�ȣ��Ա����������ò������ڸ�����Fe2O3 pH��С��������Fe3+��ˮ�⣨2����KOH����������Һ�м���ϡ���ᣬ���ɰ�ɫ�����������μ�ϡ���������ɵij����ܽ⣻����Ũ�� ��ȴ�ᾧ
��������
�����������1���پۺ������������ھ�ˮ��ԭ���Ǿۺ���������Fe3+ˮ�����Fe(OH)3���壬���������ǿ���������ã�
�������������еġ�������������ʹ�õ���������HNO3�����������õ����ӣ�����ԭ��ΪNO,����ɻ�����Ⱦ���Ľ��������ʹ����ɫ������H2O2����O2��O3�ȣ����Ҵ����л���ۺ����������Σ����л����Ҵ��е��ܽ�ȱ���ˮ��С��Ũ��ʱ�����м���һ�������Ҵ���Ŀ���ǽ��;ۺ����������ܽ�ȣ��Ա��������Ҵ����ӷ�������ʹ���ò������ڸ��
�ۼ����Լ�Y��Ŀ���������ᣬ������Һ��pH�������Լ�Ӧ�üȿ��Է�Ӧ�����ᣬ�ֲ��������ʣ���YΪFe2O3����Һ��pH��[Fe2(OH)x(SO4)y]n ��x��ֵ�нϴ�Ӱ�죨��ͼ1��ʾ������Һ��pH��С��pH��3����������Fe3+��ˮ�⣬�ε�ˮ��̶ȼ�С����˵��¾ۺ���������x��ֵ��С��
��2����ΪʹAl��Fe�Ͻ���Al�ܽ⣬��Fe���ܽ⣬���������������ӣ�Ӧ�ü���ֻ��Al��Ӧ��KOH��Һ��������һ�ֳ������������Σ������Լ�XӦΪKOH��
�ڸ���ͼ2��ʾ�������ܽ�����ߣ���֪�¶����ߣ��������ܽ����������Һ���Ʊ����������ʵ�鲽��������Һ���м��������ĺ�������м�����������ݲ��������ˣ���ȥ�������ʣ���������Һ�м�������ϡ���ᣬ������Ӧ��AlO2-+H++H2O=Al(OH)3��,���ɰ�ɫ�����������μ�ϡ���������ɵij����ܽ⣻������Ӧ��Al(OH)3+3H+=Al3++3H2O����������Һ����Ũ������ȴ�ᾧ�����ˣ�Ϊ�����������ܽ⣬�þƾ�ϴ�Ӿ��壬����õ��������塣


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
X��Y��Z��WΪǰ������Ԫ����ԭ��������������X�ĵ��Ӳ������ں����������YԪ�ػ�̬ԭ�Ӻ���δ�ɶԵ�����Ϊ2��X��Y�γɵĻ������ڳ�����Ϊ������Һ��R��ZԪ��ԭ��������Ӳ���s��p��������ȣ�W��̬ԭ��3d����ĵ�������4s�����������3������ش��������⣺
��1��Y��̬ԭ�ӵļ۵����Ų�ͼΪ �����һ��������ͬ����Ԫ�����ɴ�С�ŵ� λ��
��2��W��Ԫ������Ϊ �����̬ԭ�Ӻ����� �ֿռ��˶�״̬��ͬ�ĵ��ӡ�
��3��R������ԭ�Ӳ�ȡ���ӻ���ʽΪ ��д��R��һ���ȵ����壺 �����ѧʽ����
��4��Z��Y��һ�������¿��γɸ�Ӳ�ȵĻ�����û�����ľ�������Ϊ ������Z��Y���ɵ���С��Ϊ Ԫ����
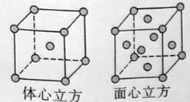
��5��W�ĵ�����900������Ϊ������������������910������Wת��Ϊ�����������������������ṹ�ֱ���ͼ��ʾ�����־����о����������ԭ�Ӽ������ͬ������800����1000���£������ܶ�֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
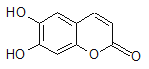
����Ŀ���в�ҩ��Ƥ�к��е���Ҷ��������ÿ���۵��ʾһ��̼ԭ�ӣ���ԭ��δ�����������п������á���1 mol��Ҷ�������ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ�������ĵ�Br2��NaOH�����ʵ����ֱ�Ϊ�� ��
A��2 mol Br2 2 mol NaOH
B��2 mol Br2 3 mol NaOH
C��3 mol Br2 4 mol NaOH
D��4 mol Br2 4 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ļ�����A������Է�������Ϊ104��̼����������Ϊ92.3%��
��1��A�ķ���ʽΪ________________________��
��2��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ____________________________��
��3����֪��![]()
![]()
![]() �� ��д��A��ϡ�����KMnO4��Һ
�� ��д��A��ϡ�����KMnO4��Һ
�ڼ��������·�Ӧ������Ľṹ��ʽ__________________________________��
��4����һ�������£�A��������Ӧ���õ��Ļ�������̼����������Ϊ85.7%��д���˻�����Ľṹ��ʽ______________________________��
��5����һ�������£���A�ۺϵõ��ĸ߷��ӻ�����Ľṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬����ɵĻ������0.1mol����ȫȼ�յ�0.15mol CO2��3.6g H2O�����й��ڸû�������˵����ȷ���ǣ� ��
A��һ������ϩ B��һ��û����ϩ C��һ���м��� D������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±������ʵķ��������ȫ��ȷ����
��� | A | B | C | D |
ǿ����� | Ba(OH)2 | ���� | HClO4 | BaSO4 |
������� | HI | CaCO3 | HClO | NH3��H2O |
�ǵ���� | SO2 | NH3 | Cl2 | �Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ұ�����������ֳ��÷����ǣ�A���ȷֽⷨ B���Ȼ�ԭ���� C����ⷨ��������������ǰ��λ�Ľ�������������ͭ��������������ѧ����ʽ��дÿ��2�֣�����ÿ��1����
�� ұ�����õ��ķ����� ��
�� ұ������ͭ�ij��÷����� ��
�� д����������Ȼ�þ��ȡ����þ�Ļ�ѧ��Ӧ����ʽ�� ��
��2���������������������ѳ�Ϊ���ͬ�ĺ���������ѧ����ʽ��дÿ��2�֣�����ÿ��1����
�� ��������ЧӦ����Ҫ������ ��
����ú̿Ϊ������Դ�ṹ����������γɣ��γ���������������� ���γɹ��̷����Ļ�ѧ��Ӧ�У� �� ��д����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����γ���λ�����ǣ� ��
A��Ag+ NH3 B��Cu2+ NH3 C��H+ H2O D��Ag+ CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����еݱ���ɲ���ȷ����
A. N a��Mg��Alԭ�ӵ�ʧ������������
B. Si��P��SԪ�ص���������ϼ����ν���
C. C��N��O��ԭ�Ӱ뾶���μ�С
D. Cl��Br��I����̬�⻯����ȶ������μ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com