
某化合物M(式量为80)俗称黑肥宝,它由原子序数不大于20的X、Y、Z三种元素组成,X、Y、Z的原子序数依次增大,其关系为Z=X+2Y。X、Y是同周期相邻的两种元素。M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,A在高温条件下可分解产生一种有温室效应的气体。(注:以下回答若涉及到具体物质均用相应的化学式或元素符号表示)
(1)化合物M的化学式为 ;Z的原子结构示意图为 。
(2)写出下列反应的化学方程式。A在高温下分解: ; M与水反应生成A和B: 。
(3)Z的氢化物可作为一种储氢材料,写出其与水反应的化学方程式 。
(4)储氢材料的研究很广泛。下列物质中,可作为储氢材料的是 。(填编号)
| A.Ca(OH)2 | B.MgH2 | C.O2 | D.LaNi5 |
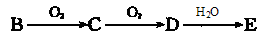 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子 。  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列物质的转化在给定条件下能实现的是
①氯化钠饱和溶液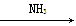
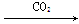 NaHCO3(s)
NaHCO3(s)
②N2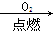 NO2
NO2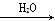 HNO3
HNO3
③海水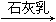 Mg(OH)2
Mg(OH)2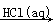 MgCl2(aq)
MgCl2(aq) MgCl2(s)
MgCl2(s)
④Al2O3 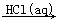 AlCl3(aq)
AlCl3(aq) 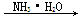 Al(OH)3
Al(OH)3
⑤重晶石(BaSO4) 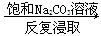 BaCO3
BaCO3 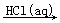 BaCl2(aq)
BaCl2(aq)
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对下列实验现象的描述不正确的是
| A.光亮的金属Na暴露在空气中,表面逐渐变暗 |
| B.将SO2通入品红溶液,品红溶液褪色 |
| C.将Mg(OH)2固体投入FeCl3溶液中,无明显现象 |
| D.浓硫酸与Cu混合加热,可能有白色固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
香料Ⅴ的制备方法如下:
(1)化合物I的分子式为 ,Ⅳ中含氧官能团的名称是 。
(2)化合物I可由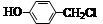 经两步反应制得,写出第一步反应的化学方程式 。
经两步反应制得,写出第一步反应的化学方程式 。
(3)1mol的化合物II和Ⅲ分别与H2反应,最多消耗H2的物质的量之比为 。
(4)该工艺中第①步的目的是 。为检验①中CH3I的碘原子,实验室的操作是:取少量CH3I于试管中,加入足量的NaOH水溶液,加热充分反应,冷却后加入 ,再加入少量硝酸银溶液。
(5)芳香化合物Ⅵ是Ⅲ的一种无甲基同分异构体,能发生水解反应和银镜反应,Ⅵ的结构简式为 。
(6)一定条件下,化合物Ⅳ与乙二醇发生类似反应④的反应,该有机产物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为: .其电极均由石墨材料做成,则电解时不断消耗的电极是 ;(填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 ;
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH+3H2O═2Na[Al(OH)4]+6Ag,则负极的电极反应式为 ,正极附近溶液的pH (填变大、不变或变小)。
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。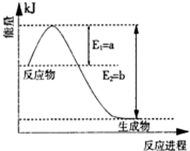
(1)图是在一定温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出合成氨的热化学反应方程: (△H的数值用含字母a、b的代数式表示)。
(2)工业合成氨反应如下,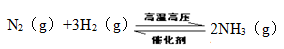
在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: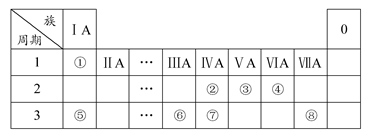
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) ;
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为 。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为 。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应: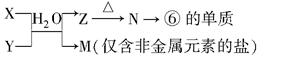
①X溶液与Y溶液反应的离子方程式为 ;
②N→⑥的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
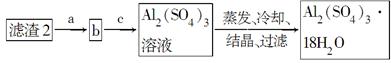
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:
已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(一)、某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
 H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com