
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为__________。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=______________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(g)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol C12和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=______________。
②该反应的△H________0(填“>”或“<”) ,理由是____________________。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl
NHCl2(l)+2HCl(g),测得平衡时Cl

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。
②计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】 ![]()
![]() +11.3 kJ/mol NH2Cl+H2O═NH3+HClO 6.25×10-8mol·L-1·min-1 < 温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小 AB B 0.5MPa
+11.3 kJ/mol NH2Cl+H2O═NH3+HClO 6.25×10-8mol·L-1·min-1 < 温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小 AB B 0.5MPa
【解析】试题分析:(1)①一氯胺(NH2Cl)是共价化合物,氮原子分别与氢原子、氯原子成键。
②反应物的总键能-生成物的总键能=焓变。
③一氯胺水解,生成具有强烈杀菌作用的物质是次氯酸。
(2)①甲容器中,0~40 min内n(Cl2)的变化为0.5mol,c(Cl2)的变化为0.5mol/L, c(NH3)变化为0.25mol/L,根据![]() 计算v(NH3)。
计算v(NH3)。
②乙容器达到平衡用时短,反应速率快,所以温度高,平衡时氯气的物质的量大,说明升高温度平衡逆向移动。
③A.根据![]() ,NHCl2是液体,m是变量,密度是变量;
,NHCl2是液体,m是变量,密度是变量;
B.投料比不等于系数比,反应过程中 C12和NH3物质的量之比是变量;
C.在原容器中充入一定量氦气,反应体系的浓度不变,平衡不移动;
D. NHCl2是液体,加入NHCl2,平衡不移动;
(3)①该反应![]() ,增大压强,平衡正向移动;。
,增大压强,平衡正向移动;。
②根据图像C点时c(HCl)=c(Cl2),利用“三段式”可计算该、Cl2、NH3、HCl的物质的量比。
解析:(1)①根据分析,NH2Cl的电子式为![]()
![]() 。
。
②根据反应物的总键能-生成物的总键能=焓变,Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g) △H=243.0+391.3×3-391.3×2-191.2-431.8=+11.3 kJ/mol。
③一氯胺水解,生成具有强烈杀菌作用的物质是次氯酸和氨气,方程式为NH2Cl+H2O═NH3+HClO。
(2)①甲容器中,0~40 min内n(Cl2)的变化为0.5mol,c(Cl2)的变化为0.5mol/L, c(NH3)变化为0.25mol/L, v(NH3)= ![]() 6.25×10-8mol·L-1·min-1 。
6.25×10-8mol·L-1·min-1 。
②温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小,所以该反应△H<0。
③ A、根据![]() ,NHCl2是液体,m是变量,密度是变量,密度不变一定平衡,故A正确;
,NHCl2是液体,m是变量,密度是变量,密度不变一定平衡,故A正确;
B.投料比不等于系数比,反应过程中 C12和NH3物质的量之比是变量,C12和NH3物质的量之比不变,一定平衡,故B正确;
C.在原容器中充入一定量氦气,反应体系的浓度不变,平衡不移动,转化率不变,故C错误;
D. NHCl2是液体,增加NHCl2,浓度不变,平衡不移动,故D错误。
(3)①该反应![]() ,增大压强,平衡正向移动,压强越大Cl2转化率越高,故B点最大;
,增大压强,平衡正向移动,压强越大Cl2转化率越高,故B点最大;
②根据图像C点时c(HCl)=c(Cl2),设氨气的变化量为xmol
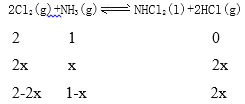
2-2x=2x
X=0.5mol,
Kp(C)=  0.5 。
0.5 。


科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列措施可以提高(正)的是_____________ (填序号)。
2NH3(g) ΔH<0,下列措施可以提高(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) ![]() 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:_________。标况下,每消耗1.12L氨气,转移_________mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5kJ/mol; N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是
A. 二氧化硫具有氧化性,可用于漂白纸浆
B. 葡萄糖具有还原性,可用于化学镀银
C. 氢氧化铝受热易分解,可用作胃酸中和剂
D. 生石灰能与水反应,可用来干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法:Ⅰ、原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________________。
a、碳酸氢钠难溶于水 b、碳酸氢钠受热易分解
c、碳酸氢钠的溶解度相对较小,在溶液中首先结晶析出
Ⅱ.实验探究
(1)一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

回答下列有关问题:
①乙装置中的试剂是________________;
②丁装置中稀硫酸的作用是________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
(2)另一位同学用图中戊装置(其他装置未画出)进行实验。
①实验时,须先从_________管通入_________气体,再从________管中通入________气体。
②有同学建议在戊装置的b导管下端连接己装置,理由是________________________。
(3)请再写出一种实验室制取少量碳酸氢钠的方法_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是

A. K+向a极移动
B. b 极的电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-
C. 用该电池给铁棒镀铜,则铁棒与 b 极相连
D. 电池工作一段时间后,电解液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
A.1:3 B.2:5 C.1:4 D.2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类时,按强电解质、弱电解质 、非电解质排列的正确的是( )
A.NaCl、HF、CuB.NaHSO4、CH3COONH4、CCl4
C.BaSO4、CH3COOH、C2H5OHD.Cu(OH)2 、HCN、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的乙烯以得到纯净乙烷的方法是( )
A. 通过足量的NaOH溶液 B. 通过足量的溴水
C. 在Ni催化、加热条件下通入H2 D. 通过足量的酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com