
【题目】聚酯纤维(涤纶)是重要的衣服面料,以下是一种合成路线(部分反应条件略去).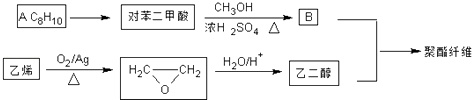
已知:酯与醇(或酚)可发生如下酯交换反应:RCOOR′+R″OH ![]() RCOOR″+R′OH
RCOOR″+R′OH
(1)C8H10的系统命名为;它的同系物分子通式为 .
(2)在其它催化剂作用下,乙烯与氧气反应的产物是(写结构简式).
(3)若B过量,生成的聚酯纤维可表示为: ![]() 若乙二醇过量,则生成的聚酯纤维可表示为 .
若乙二醇过量,则生成的聚酯纤维可表示为 .
(4)将废涤纶和甲醇在一定条件下反应,对聚合物进行降解,生成物是(填名称).
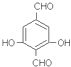
(5)对苯二甲酸有多种芳香族同分异构体,写出一种满足以下条件的有机物的结构简式 . ①遇氯化铁溶液显紫色;②能发生银镜反应;③有三种不同化学环境的H原子.
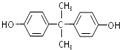
(6)聚合物PC也由酯交换反应合成,其结构可表示为: ![]() 合成PC的2种单体的中:醇(或酚)的结构简式为 , 酯的名称为 .
合成PC的2种单体的中:醇(或酚)的结构简式为 , 酯的名称为 .
【答案】
(1)对﹣二甲苯;CnH2n﹣6(n≥6)
(2)CH3CHO
(3)![]()
(4)对苯二甲酸二甲酯、乙二醇
(5)
(6) ;碳酸二苯酚酯
;碳酸二苯酚酯
【解析】解:根据各物质的转化关系可知,A的分子式为C8H10 , 能生成对苯二甲酸,所以A为对﹣二甲苯为( ![]() ),对﹣二甲苯与甲醇在浓硫酸的作用下发生酯化反应得B为
),对﹣二甲苯与甲醇在浓硫酸的作用下发生酯化反应得B为 ![]() ,乙烯催化氧化得环氧乙烷,环氧乙烷与水反应得乙二醇,乙二醇与B发生酯交换反应得聚酯纤维为
,乙烯催化氧化得环氧乙烷,环氧乙烷与水反应得乙二醇,乙二醇与B发生酯交换反应得聚酯纤维为 ![]() 或:
或: ![]() ,(1)根据上面的分析可知,A为对﹣二甲苯,它的同系物分子通式为CnH2n﹣6(n≥6),所以答案是:对﹣二甲苯;CnH2n﹣6(n≥6);(2)在其它催化剂作用下,乙烯与氧气发生催化氧化可得乙醛,结构简式为CH3CHO,所以答案是:CH3CHO;(3)若乙二醇过量,则生成的聚酯纤维可表示为
,(1)根据上面的分析可知,A为对﹣二甲苯,它的同系物分子通式为CnH2n﹣6(n≥6),所以答案是:对﹣二甲苯;CnH2n﹣6(n≥6);(2)在其它催化剂作用下,乙烯与氧气发生催化氧化可得乙醛,结构简式为CH3CHO,所以答案是:CH3CHO;(3)若乙二醇过量,则生成的聚酯纤维可表示为 ![]() ,所以答案是:
,所以答案是: ![]() ;(4)将废涤纶和甲醇在一定条件下反应,对聚合物进行降解,根据题中酯交换原理可知,生成物是对苯二甲酸二甲酯、乙二醇,所以答案是:对苯二甲酸二甲酯、乙二醇;(5)对苯二甲酸的同分异构体符合下列条件①遇氯化铁溶液显紫色,说明有酚羟基;②能发生银镜反应,说明有醛基;③有三种不同化学环境的H原子,则符合条件的一种结构为
;(4)将废涤纶和甲醇在一定条件下反应,对聚合物进行降解,根据题中酯交换原理可知,生成物是对苯二甲酸二甲酯、乙二醇,所以答案是:对苯二甲酸二甲酯、乙二醇;(5)对苯二甲酸的同分异构体符合下列条件①遇氯化铁溶液显紫色,说明有酚羟基;②能发生银镜反应,说明有醛基;③有三种不同化学环境的H原子,则符合条件的一种结构为 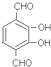 (等),所以答案是:
(等),所以答案是:  ;(6)根据酯交换原理可知,合成
;(6)根据酯交换原理可知,合成 ![]() 的两种单体为
的两种单体为 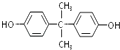 和碳酸二苯酚酯,所以醇(或酚)的结构简式为
和碳酸二苯酚酯,所以醇(或酚)的结构简式为  ,酯的名称为碳酸二苯酚酯,所以答案是:
,酯的名称为碳酸二苯酚酯,所以答案是:  ;碳酸二苯酚酯.
;碳酸二苯酚酯.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于含氮化合物的说法不正确的是
A.工业上可使用液氮做制冷剂B.NO2 能导致“光化学烟雾"的形成
C.浓硝酸可用铝槽车运输D.硫酸铁又称肥田粉,属于硝态氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是( )
A. MgSO4=Mg+2+SO4-2
B. Ba(OH)2=Ba2++OH2-
C. Al2(SO4)3=2Al3++3SO42-
D. KClO3=K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)加热铁屑与稀硫酸时常常需要补充蒸馏水,原因。
(2)实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是。
(3)为防止Fe2+被氧化,实验中可采取的措施是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A.用分液漏斗、烧杯、蒸馏水分离Br2和CCl4的混合物
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定条件下,一定能大量共存的是( )
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO ![]() 、NO
、NO ![]()
B.c(H+)=1×10﹣1mol?L﹣1的溶液中:Cu2+、A13+、SO ![]() 、NO
、NO ![]()
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH ![]() 、S2﹣、Br﹣
、S2﹣、Br﹣
D.水电离出的c(H+)为1×10﹣12 mol?L﹣1的溶液中:Na+、Mg2+、Cl﹣、SO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
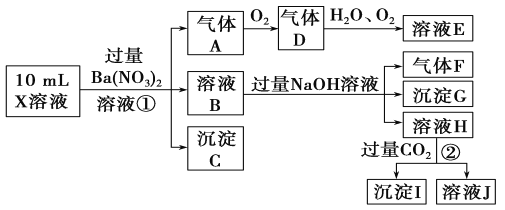
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________________________;可能存在的离子是______________________________;
(2)写出有关离子方程式:步骤①中生成A__________________________;步骤②生成沉淀I___________________________________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量为0.07 mol,能说明该溶液不能确定的阴离子存在的理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y.X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2 , 其水溶液呈弱酸性.完成下列填空
(1)A元素的不同原子有;B原子的核外电子占据了个轨道
(2)C原子核外最外层的电子排布式 , C2和过量X反应的化学方程式 , 每生成1mol单质,转移的电子物质的量为mol
(3)D2的化学性质稳定,原因是
(4)组成为的物质B4A3D2中所含的化学键有 , 其水溶液中各离子浓度大小顺序为
(5)液态X能自身电离,其阴离子电子式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com