
【题目】用相对分子质量为57的烷基取代甲苯苯环上的一个氢原子,所得的化合物可能有( )
A. 6种B. 9种C. 12种D. 16种
科目:高中化学 来源: 题型:
【题目】CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )

A. CaTiO3的摩尔质量为236
B. CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻
C. CaTiO3晶体中每个Ti4+与12个O2-紧相邻
D. CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活生产中应用广泛。
(1)硫酸铁可作絮凝剂,常用于净水,其原理是(用离子方程式表示)______________________。
(2)已知25°C时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=______________
Fe3++3H2O的平衡常数K=______________
(3)电浮选凝聚法是工业上采用的一种污水处理方法,保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某研究小组设计装置如图所示。

①装置B中通入空气的电极反应是_______________
②装置A中,阳极的电极反应式分别为Fe-2e-=Fe2+、_______________
③实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的___________
a.H2SO4b.BaSO4c.Na2SO4d.NaOHe.CH3CH2OH
(4)工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。
①制备过程要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学方程式__________________。
②配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3![]() [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知:[Fe(C2O4)3]3-的稳定常数K1=1020, Fe(SCN)3的稳定常数K2=2×103,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案_______________________。
。已知:[Fe(C2O4)3]3-的稳定常数K1=1020, Fe(SCN)3的稳定常数K2=2×103,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把体积相同的甲烷和氯气充入一个集气瓶中,光照一段时间后,发现气体的黄绿色变浅,集气瓶壁上有淡黄绿色液滴,此时集气瓶内的物质最多可能有( )
A. 4种B. 5种C. 6种D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
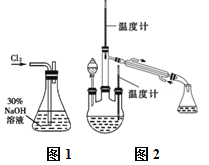
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com