
【题目】三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。

已知: PCl3熔点为-112℃,沸点为75.5℃。易被氧化,遇水易水解。与Cl2反应生成PCl5。
(1)A中反应的化学方程式为__________________。
(2)B中所装试剂名称是___________________,E中碱石灰的作用是___________________。
(3)实验时,检查装置气密性后,向C装置的曲颈甑中加入红磷,打开止水夹K通入干燥的CO2,一段时间后,关闭K,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是____________________。CO2______(选填“能”或“不能”)用Cl2代替,理由是________________。
(4)D中烧杯中盛装__________,其作用是_______________。
(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化的离子方程式_______________。
【答案】 4 HCl(浓) + MnO2 ![]() MnCl2 + Cl2 ↑+ 2 H2O 浓硫酸 吸收未反应完的氯气,防止污染空气,防止空气中水蒸气进入产品收集装置 排尽曲颈甑中的空气,防止发生副反应 不能 防止氯气过量,生成PCl5 冷水 冷凝,便于收集PCl3产品
MnCl2 + Cl2 ↑+ 2 H2O 浓硫酸 吸收未反应完的氯气,防止污染空气,防止空气中水蒸气进入产品收集装置 排尽曲颈甑中的空气,防止发生副反应 不能 防止氯气过量,生成PCl5 冷水 冷凝,便于收集PCl3产品 ![]() +4H++2NO3-=H3PO4+2NO2↑+H2O
+4H++2NO3-=H3PO4+2NO2↑+H2O
【解析】(1)A中利用二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为4 HCl(浓) + MnO2 ![]() MnCl2 + Cl2 ↑+ 2 H2O;(2)B中所装试剂用于干燥氯气,名称是浓硫酸,E中碱石灰的作用是吸收未反应完的氯气,防止污染空气,防止空气中水蒸气进入产品收集装;(3)通干燥CO2的作用是排尽曲颈甑中的空气,防止发生副反应。CO2不能用Cl2代替,防止氯气过量,生成PCl5;(4)D中烧杯中盛装冷水,其作用是冷凝,便于收集PCl3产品;(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化生成磷酸,同时生成二氧化氮和水,反应的离子方程式
MnCl2 + Cl2 ↑+ 2 H2O;(2)B中所装试剂用于干燥氯气,名称是浓硫酸,E中碱石灰的作用是吸收未反应完的氯气,防止污染空气,防止空气中水蒸气进入产品收集装;(3)通干燥CO2的作用是排尽曲颈甑中的空气,防止发生副反应。CO2不能用Cl2代替,防止氯气过量,生成PCl5;(4)D中烧杯中盛装冷水,其作用是冷凝,便于收集PCl3产品;(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化生成磷酸,同时生成二氧化氮和水,反应的离子方程式![]() +4H++2NO3-=H3PO4+2NO2↑+H2O。
+4H++2NO3-=H3PO4+2NO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】加碘食盐中碘元素以KIO3形式存在,KIO3是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。某化学兴趣小组对加碘食盐中的KIO3含量进行探究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取wg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI 溶液;
c.以淀粉为指示剂,用物质的量浓度为1.0×10-3mol/L的Na2S2O3溶液进行滴定 (滴定时的反应方程式: I2+2S2O32-=2I-+S4O62-)。
操作b 涉及的主要反应的离子方程式为_____;滴定时,Na2S2O3溶液应放在_____(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是________mg/kg (以含w的代数式表示)。
(2) 学生乙对纯净的NaCl (不含KIO3 )进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
② | 滴入淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 放置片刻,再滴加稀H2SO4,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因是(用离子方程式表示):________。由学生乙的实验结果推知,学生甲的实验结果将_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
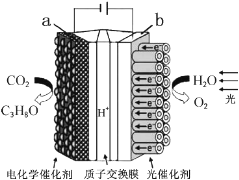
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列微粒中,只有氧化性的是_____________ (用字母填写,下同),既有氧化性又有还原性的是___________________。
A. Cl2 B. S2— C. H+ D. Na E. FeCl2
(2)在4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O反应中
MnCl2+Cl2↑+2H2O反应中
①氧化剂是________,氧化产物是________;
②被氧化与未被氧化的HCl的质量之比为_______,若有7.3gHCl被氧化,转移电子的物质的量为________;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中错误的是( )


A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②中钢闸门应与外接电源的负极相连
C. 装置③的总反应式是Cu+2Fe3+=Cu2++2Fe2+
D. 装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
B.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.碳酸氢钙溶液和足量氢氧化钠溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
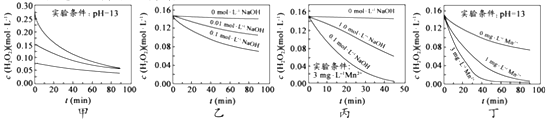
A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液PH 越小,H2O2分解速率越快
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为________________
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色) ![]() Q(还原性,无色)
Q(还原性,无色)
(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、___________、______________
(4)如何判断滴定达到终点:_______________________________
(5)步骤2的主要作用是________________
(6)硫酸亚铁铵溶液的标定浓度是___________mol/L(保留三位有效数字)
(7)若滴定前锥形瓶中有水,对测定结果的影响是______(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com