
【题目】Ⅰ.25℃,两种酸的电离平衡常数如右表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为________________
Ⅱ.某化学小组设计下列实验测定硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的标定浓度:
步骤1:取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加入2滴R溶液作指示剂,继续滴定至终点,消耗的体积为10.10mL.
步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL。
已知:①6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,其中Cr3+为绿色
②R溶液的变色原理:R(氧化型,紫红色) ![]() Q(还原性,无色)
Q(还原性,无色)
(3)该实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、___________、______________
(4)如何判断滴定达到终点:_______________________________
(5)步骤2的主要作用是________________
(6)硫酸亚铁铵溶液的标定浓度是___________mol/L(保留三位有效数字)
(7)若滴定前锥形瓶中有水,对测定结果的影响是______(填“偏大”、“偏小”或“无影响”)
【答案】 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) H2SO3+HCO3-=HSO3-+CO2↑+H2O 酸式滴定管 量筒 当滴入最后一滴硫酸亚铁铵溶液,紫红色褪色,且30s保持不变 校正指示剂,减少实验误差 0.180 无影响
【解析】Ⅰ.(1)Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2OHSO3-+OH-,HSO3-+H2OH2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(2)由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;
Ⅱ. (3)滴定实验中需要用到的主要玻璃仪器有锥形瓶、胶头滴管、酸式滴定管、量筒等,故答案为:酸式滴定管;量筒;
(4)根据,R溶液的变色原理:R(氧化型,紫红色) ![]() Q(还原性,无色),滴定终点时,当滴入最后一滴硫酸亚铁铵溶液,紫红色褪色,且30s保持不变,故答案为:当滴入最后一滴硫酸亚铁铵溶液,紫红色褪色,且30s保持不变;
Q(还原性,无色),滴定终点时,当滴入最后一滴硫酸亚铁铵溶液,紫红色褪色,且30s保持不变,故答案为:当滴入最后一滴硫酸亚铁铵溶液,紫红色褪色,且30s保持不变;
(5)步骤2:重复操作1实验,接近终点时加入4滴R溶液,消耗的体积为10.20mL,通过校正指示剂用量,减少实验误差,故答案为:校正指示剂,减少实验误差;
(6)根据6Fe2+ +Cr2O72-+14H+=6Fe3+ +2Cr3+ +7H2O,n(Fe3+)=6 n(Cr2O72-)=6×0.020L×0.015mol/L=0.0018mol,消耗的硫酸亚铁铵溶液的体积平均为10.15mL,则硫酸亚铁铵溶液的标定浓度=![]() =0.180 mol/L,故答案为:0.180;
=0.180 mol/L,故答案为:0.180;
(7)若滴定前锥形瓶中有水,不影响标准溶液的用量和滴定终点的判断,对测定结果无影响,故答案为:无影响。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】有四瓶常用溶液:①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液.不用其他试剂,可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是( )
A.④①③②
B.①③④②
C.①④③②
D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示。

已知: PCl3熔点为-112℃,沸点为75.5℃。易被氧化,遇水易水解。与Cl2反应生成PCl5。
(1)A中反应的化学方程式为__________________。
(2)B中所装试剂名称是___________________,E中碱石灰的作用是___________________。
(3)实验时,检查装置气密性后,向C装置的曲颈甑中加入红磷,打开止水夹K通入干燥的CO2,一段时间后,关闭K,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是____________________。CO2______(选填“能”或“不能”)用Cl2代替,理由是________________。
(4)D中烧杯中盛装__________,其作用是_______________。
(5)PCl3水解得到亚磷酸(分子式:H3PO3。二元弱酸),写出亚磷酸钠被浓硝酸氧化的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是

A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是( )
A.溶液呈电中性,而胶体可以带电荷
B.胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀
C.某纳米材料微粒直径为30nm,因此该纳米材料属于胶体
D.往Fe(OH)3胶体中逐滴加入稀硫酸会产生先沉淀而后沉淀逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是
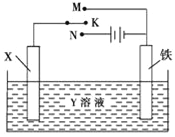
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com