
����Ŀ������˵����ȷ����
A. FeCl3��Һ������ͭ��ӡˢ��·����������÷�Ӧ���û���Ӧ
B. �ö��Ե缫��⺬��H218O����ͨˮʱ���������ܲ���������Է���������ͬ��������
C. ��ӦA(g) ![]() B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=��(Ea��Eb)kJ/mol
B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=��(Ea��Eb)kJ/mol
D. 3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ����������С��2x%����A���ʿ���Ϊ�Ҵ�
���𰸡�D
��������A��FeCl3��ͭ�ķ�Ӧ�������û���Ӧ��ѡ��A����B���ö��Ե缫��⺬��H218O����ͨˮʱ��������16OH-��18OH-ͬʱ�ŵ磬�����ɵ�������16O2��18O2��16O18O��������������Է���������ͬ�������ӣ�ѡ��B����C����ӦA(g) ![]() B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=(Ea��Eb)kJ/mol��ѡ��C����D����ij��Һ��
B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol�����H=(Ea��Eb)kJ/mol��ѡ��C����D����ij��Һ��![]() <1g/mLʱ���������������Һ����������С��ƽ��ֵ�����Ҵ���Һ���ܶ�С��ˮ����A����Ϊ�Ҵ�ʱ����3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ����������С��2x%��ѡ��D��ȷ����ѡD��
<1g/mLʱ���������������Һ����������С��ƽ��ֵ�����Ҵ���Һ���ܶ�С��ˮ����A����Ϊ�Ҵ�ʱ����3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ����������С��2x%��ѡ��D��ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ������������������о���������Ҫ����;����ͼ�Ǵ����������Ʊ����Ĺ������̣�

��֪����1�����������Ҫ�ɷ���Al2O3�������������SiO2��Fe2O3�����ʣ�
��2����Һ�еĹ�������ƫ�����Ʒ�Ӧ�������ɹ������γ�������ѧ��Ӧ����ʽΪ2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8��+4NaOH����ش��������⣺
��1����������Al2O3������������Һ��Ӧ�����ӷ���ʽΪ_________________________________��
��2���ڹ��������С��ữ��ʱ��������������B��________��������_______________________��д���ữ���̷�����Ӧ�Ļ�ѧ����ʽ��________________________________��
��3����ҵ����Al2O3��C��Cl2�ڸ��������·�Ӧ��ȡAlCl3��������ÿ����6.0 g̼���ʣ�ת��1 mol���ӣ���Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4��ijͬѧ�Ʋ������������������ȷ�Ӧ�õ����������л�����Fe2O3����������·�������֤��ȡһ���������Ͷ������ϡ�����У���Ӧһ��ʱ�����Ӧ��Ļ��Һ�еμ����ʼ���Һ���۲���Һ��ɫ�ı仯������֤�����������Ƿ���Fe2O3��
�����ʼ���_________(�ѧʽ)�����жϸ�ͬѧ��Ƶ�ʵ�鷽���ĺ�����_________(�������������������ԭ����_______________________________________����������������д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������ ClO2����Ĵ��ȣ��һ�Ӱ��ClO2�������ʣ����������ͼ��ʾ��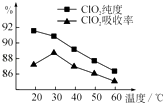
��1����ͼ��֪����Ӧʱ��Ҫ���Ƶ������¶����棬Ҫ�ﵽ��Ҫ����Ҫ��ȡ�Ĵ�ʩ�� ��
��2����֪���������е���Ԫ�������������¿ɱ�ClO3��������SO42�� �� ��д���Ʊ��������ȣ�ClO2�������ӷ���ʽ�� ��
��3����У��ѧѧϰС�����ԡ� ![]() ����Ϊ����ClO2���ʵ�ָ�꣮��ȡNaClO3��Ʒ6.0g��ͨ����Ӧ�����ջ��400mL ClO2��Һ��ȡ����Һ20mL��37.00mL 0.500molL��1 ��NH4��2Fe��SO4��2��Һ��ַ�Ӧ������Fe2+����0.050 0molL��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00mL����Ӧԭ��Ϊ�� 4H++ClO2+5Fe2+�TCl��+5Fe3++2H2O
����Ϊ����ClO2���ʵ�ָ�꣮��ȡNaClO3��Ʒ6.0g��ͨ����Ӧ�����ջ��400mL ClO2��Һ��ȡ����Һ20mL��37.00mL 0.500molL��1 ��NH4��2Fe��SO4��2��Һ��ַ�Ӧ������Fe2+����0.050 0molL��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00mL����Ӧԭ��Ϊ�� 4H++ClO2+5Fe2+�TCl��+5Fe3++2H2O
14H++Cr2O72��+6Fe2+�T2Cr3++6Fe3++7H2O
�Լ���ClO2�ġ����ʡ���д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʷ��ÿһ���ش��ֶ�������ƽ��˿�ѧ�ķ�չ���Ž��з�Ի�ѧ�Ĺ������ڣ� ��
A.��ȡ����űҩ��������
B.�����˺ϳɰ�����������
C.��ʾ��ȼ�յı���
D.�����Ԫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1molL��1�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬��ʱ��Һ�� ![]() �����������С�����䡱����
�����������С�����䡱����
��2������ˮ�м���ϡ���ᣬʹ��ǡ����ȫ�кͣ�д����Ӧ�����ӷ���ʽ����������Һ��pH7�����������=���������������ӷ���ʽ��ʾ��ԭ�� ��
��3������ˮ�м���ϡ��������Һ��pH=7����ʱ ![]() =a molL��1 ��
=a molL��1 �� ![]() ��= ��
��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���û���Ӧ�õ�����������
A. Na��FeSO4��Һ���»�� B. COͨ�����ȵ�Fe2O3
C. H2ͨ��FeSO4��Һ D. Al��Fe3O4��ϼ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ijС��ͬѧ���ձ��м���5mL1.0mol/L���ᣬ�ٷ�����ɰֽ��ĥ�����������۲����H2�����ʣ���ͼA��ʾ����÷�Ӧ��_____________(����ȡ����ȡ�)��Ӧ���������仯����ͼ�е�____________(�B����C��)��ʾ��

(2)��֪��1mo1H-H����1molN��N����lmolN-H���ֱ���Ҫ���յ�����Ϊ436kJ��946kJ��391kJ��������1mo1 NH3ʱ��Ӧ___________(��ų��������ա�)________kJ ��������
(3)Ϊ����֤Fe2+��Cu2+������ǿ��������װ���ܴﵽʵ��Ŀ�ĵ���______������ţ���д�������ĵ缫��Ӧ_____________________��������ԭ���ʱ�����缫��������ȣ���������ͨ��0.05mol����ʱ�������缫��������Ϊ________g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ũҵ���������Ƽ���������ҪӦ�ã����й����߶�������Ź㷺�о�����ش�:
(1)ij������ʵ�����ڳ��³�ѹ�£��Ե�����Һ̬ˮΪԭ���Ʊ�������ͬʱ���������ɡ�
��֪����һ���¶Ⱥ�ѹǿ�£������ȶ��ĵ�������1mol�����ʵ���ЧӦ����Ϊ�����ʵ�������(��H)�����³�ѹ�¡�������ʵ����������±���ʾ��
���� | NH3(g) | H2O(l) |
��H /kJ��mol-1 | -46 | -242 |
�����ϳɰ���Ӧ���Ȼ�ѧ����ʽΪ______________________________________��
(2)���������أ���H2��N2Ϊԭ�Ϻϳɰ���װ������ͼ��ʾ��

Q��R��Ϊ�ܻ�������ͼʾ�жϣ�������Ӧ�Ĵ���Ϊ______(�Q����R��)�������ĵ缫��ӦʽΪ_________________________________________��
(3)�����ǹ�ҵ���������Ҫԭ��֮һ�������������з�������Ҫ��Ӧ���£�
I. 4NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g����H=-906kJ/mol
4NO��g��+6H2O��g����H=-906kJ/mol
II.4NH3��g��+3O2��g��![]() 2N2��g��+6H2O��g����H=-1266kJ/mol
2N2��g��+6H2O��g����H=-1266kJ/mol
���̶�����NH3��O2 �Ļ��������һ������ͨ������д����ķ�Ӧ������Ӧ�������¶ȵĹ�ϵ��ͼ1��ʾ��
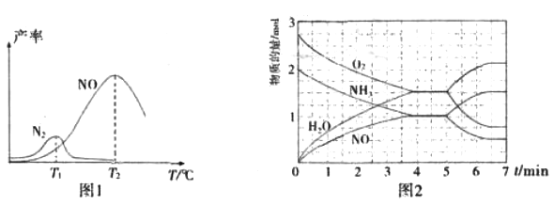
�ٴ����������У������˵��¶�Ϊ_________________(�T1����T2��)��
�ڵ���T1��ʱ��NO�IJ��ʽϵ͵�ԭ��Ϊ_____________________________________��
�۸���T2��ʱ��NO�IJ��ʽ��͵Ŀ���ԭ��Ϊ______________(��ѡ����ĸ)
A.�������Խ��� B.ƽ�ⳣ����С
C.��Ӧ������� D.��������ˮ
��T2��(T1>T2)ʱ����20L�����ܱ������г���2molNH3��2.75molO2��������Ӧ
I.��Ӧ�����и����ʵ����ʵ�������ʱ��(t)�仯��ϵ��ͼ2��ʾ��
T2��ʱ���÷�Ӧ��ƽ�ⳣ��K=________________��5minʱ���ı���ijһ������������ı����������Ϊ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ��ȫ������Ԫ�ص��� �� ��
A. Na ��K��Cl��S��O B. Fe��Zn��Cu��B
C. N��H��P��C D. Ge��CA��Cu��Mg��C
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com