
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

【答案】 放热 B 放出 46 ③ Cu2++2e-=Cu 3
【解析】(1)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;结合金属与酸的反应为放热反应分析;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热;
(3)根据原电池原理判断正负极和电极反应。
详解:(1)在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量,则图象B正确,因此,本题正确答案是:放热;B;
(2)在反应2NH3![]() N2+3H2中,断裂2molNH3共形成6molN-H键,吸收的能量为:6×391kJ=2346kJ,生成3molH-H键,1molN≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为92kJ;
N2+3H2中,断裂2molNH3共形成6molN-H键,吸收的能量为:6×391kJ=2346kJ,生成3molH-H键,1molN≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ-2254kJ=92kJ,所以当1molNH3分解吸收热量为92kJ;
因此,本题正确答案是:吸收;46。
(3)①中铜是负极,碳是正极,铁离子在正极放电生成亚铁离子,不能比较Fe2+与Cu2+氧化性强弱;②中常温下铁与浓硝酸发生钝化,铁是正极,铜是负极,不能比较Fe2+与Cu2+氧化性强弱;③中铁是负极,碳是正极,铜离子在正极得电子得到电子生成铜,能比较Fe2+与Cu2+氧化性强弱,正极的电极反应为Cu2++2e-=Cu。当导线中通过0.05mol电子时,消耗铁0.025mol×56g/mol=1.4g,析出铜是0.025mol×64g/mol=1.6g,两个电极的质量差为1.4g+1.6g=3g。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,可表明反应:A(g)+B(g)![]() C(g)+D(g) 已达化学平衡状态的是( )
C(g)+D(g) 已达化学平衡状态的是( )
A. 混合气体的压强 B. B的物质的量浓度 C. 混合气体的密度 D. v(A)正 = v(D)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 用惰性电极电解含有H218O的普通水时,阳极可能产生两种相对分子质量不同的氧分子
C. 反应A(g) ![]() B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
B(g) △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D. 3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,试根据图回答有关问题: 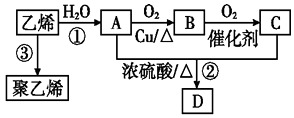
已知:有机物D是一种有水果香味的油状液体.
(1)有机物B的名称为 , 结构简式为 . 决定有机物A、C的化学特性的原子团的名称分别是 .
(2)写出图示反应②、③的化学方程式,并指明反应类型: ②; 反应类型: .
③; 反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL ﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示装置进行原电池原理的探究,下列叙述错误的是( )

A. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 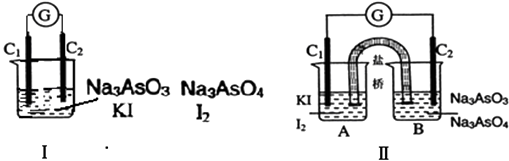
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C2做正极
D.乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com