
【题目】一定条件下,通过单质间化合可得到的是( )
A. Fe(OH)3 B. SO3 C. FeCl3 D. NO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:
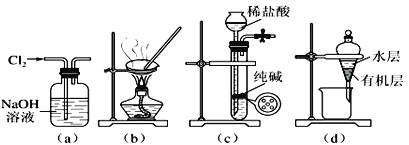
A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。

回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下面列举了一些化学键的键能数据,供计算使用
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ.mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),该反应的逆反应的△H为 ( )
A. ﹣236 kJmol﹣1 B. ﹣412 kJmol﹣1 C. +236 kJmol﹣1 D. +412 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。
)。
某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见右图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O,恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是__________________________________________。
(4)高温燃烧可将水样中的碳酸盐、碳酸氧盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;____________________________________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成 ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示.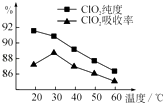
(1)据图可知,反应时需要控制的适宜温度是℃,要达到此要求需要采取的措施是 .
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO3﹣氧化成SO42﹣ , 请写出制备二氧化氯(ClO2)的离子方程式: .
(3)该校化学学习小组拟以“ ![]() ”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某小组同学在烧杯中加入5mL1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,则该反应是_____________(填“吸热”或“放热”)反应,其能量变化可用图中的____________(填“B”或“C”)表示。

(2)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应___________(填“放出”或“吸收”)________kJ 的热量。
(3)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应_____________________。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com