
����Ŀ���棨Ce)��һ����Ҫ��ϡ��Ԫ�ء��Ը���CeO2�ķϲ�����ĩ����SiO2�� Fe2O3�Լ���������������ϡ������ʣ�Ϊԭ�ϣ����ö��ַ��������档��ش��������⣺
(1)ʪ������������������IJ����������£�(��֪��CeO2������ϡ���ᣬҲ������NaOH��Һ��)
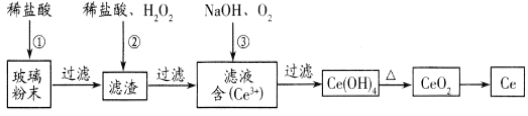
�����ijɷ���_____________________����Ӧ�������ӷ���ʽ��_____________________________��
(2)�ɷ������������������ǰ�Ce(OH)3������������Ce(OH)4�����������з����Ļ�ѧ��Ӧ����ʽΪ___________________________��
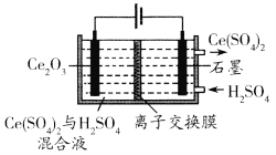
(3)���õ�ⷽ��Ҳ����ʵ����Ļ��ա������������µ��Ce2O3����ͼ���������缫��ӦʽΪ________________�����ӽ���ĤΪ________ (���������������������ӽ���Ĥ��
���𰸡�CeO2��SiO2 2CeO2 +H2O2 +6H+=2Ce3++O2��+4H2O 4 Ce(OH)3 +2H2O+ O2=4 Ce(OH)4 Ce2O3-2e- + 6H+ = 2Ce4++3 H2O ��
��������
�ϲ�����ĩ�к�SiO2��Fe2O3��CeO2�Լ���������������ϡ������ʣ�����ϡ���ᣬFe2O3ת��FeCl3��������Һ�У�����ΪCeO2��SiO2������ϡ�������H2O2��CeO2ת��ΪCe3+������ΪSiO2������ͨ��������Ce��+3����Ϊ+4���õ���ƷCe(OH)4�����ȷֽ�����CeO2�����ɵõ�Ce���Դ˽����⡣
��1��������������֪��ΪCeO2��SiO2���ܽ������ᣬ���������ijɷ���CeO2��SiO2���ټ���ϡ���ᡢH2O2��CeO2�Ϳ��Ժ�ϡ���ᡢH2O2��Ӧ����ת��ΪCeCl3��O2��H2O�����Է�Ӧ�����ӷ���ʽΪ��6H++H2O2+2CeO2��2Ce3++O2��+4H2O���ʴ�Ϊ��CeO2��SiO2��6H++H2O2+2CeO2��2Ce3++O2��+4H2O��
��2���ɷ������������������ǰ�Ce(OH)3������������Ce(OH)4�����������з����Ļ�ѧ��Ӧ����ʽΪ4Ce(OH)3+O2+2H2O��4Ce(OH)4���ʴ�Ϊ��4Ce(OH)3+O2+2H2O��4Ce(OH)4��
��3������������������Ӧ���缫����ʽΪCe2O3��2e��+6H+��2Ce4++3H2O����Ӧ���������ӣ��Ҳ���Һ�е�H+��Ҫ�ƶ�����࣬��Ӧ�������ӽ���Ĥ���ʴ�Ϊ��Ce2O3��2e��+6H+��2Ce4++3H2O������


 â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Dzⶨ���Ѿ���SO2�����ij��÷�������ԭ�����ڵ��������£��ù����Ĺ���������Һ��������Ʒ�лӷ�����SO2�����ü����Һ�ζ����ɵ��ᡣ
��ͼ��װ��װ�ã����װ�������ԣ���c��A��ע��20.00mL���Ѿƣ�10mL25%������Һ��C��D�зֱ�ע��20.00mL��5.00mLϡH2O2��Һ���ش��������⣺
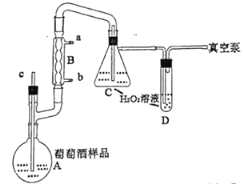
��1��װ��B��������___________������ˮ��___________���a����b�����ڽ��롣
��2��C�з�����Ӧ�Ļ�ѧ����ʽΪ___________��ʹ��D��Ŀ����___________________��
��3����ձó������ʲ��˹��죬ԭ����______________________��
��4������ʮ���Ӻϲ�C��D�е���Һ������ָʾ������Ũ��Ϊc����λΪ![]() ����NaOH����Һ�ζ�������
����NaOH����Һ�ζ�������![]() ����ȡװ�ã���A��ע��20.00mL����ˮ����ͬ���ķ������հ�ʵ�飬����NaOH��Һ
����ȡװ�ã���A��ע��20.00mL����ˮ����ͬ���ķ������հ�ʵ�飬����NaOH��Һ![]() ��������Ѿ���SO2�ĺ���Ϊ___________mg/L������c��
��������Ѿ���SO2�ĺ���Ϊ___________mg/L������c��![]() ��
��![]() ��ʾ��
��ʾ��
��5�����Ѿ��к��е�SO2��������______________________������һ�㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��Ҫ�ɷ�ΪAl2O3��������SiO2��Fe2O3)�ǹ�ҵ���Ʊ�����������Ҫԭ�ϣ���ҵ����ȡ���Ĺ����������£�
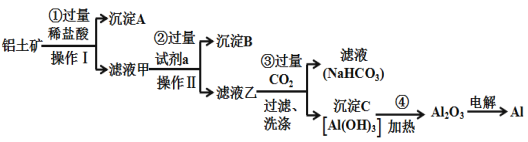
��1������A�Ļ�ѧʽ��_________���Լ�a�Ļ�ѧʽΪ______________��
��2����������ͨ�����CO2����������C�����ӷ���ʽΪ______________________________________��
��3��Al2O3�������Ļ�ѧ��������Ϊ___________________��
��4����ҵ���õ������Al2O3�ķ����Ʊ�������,��������ӦʽΪ______________________________��
��5���������У�������Al��Fe2O3������ȷ�Ӧ�����к��Ӹֹ졣����Fe2O3�����ۻ�������ܶ����������������ȼ��������������в���������������ȼ�������___________��
a MgO b V2O 5 c Fe3O4 d MnO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д���пհף�
��1������ 6.02��1023�� H ��H2O�������ʵ�����_______��1L 1 mol��L -1Na2SO4��Һ�� ����_____�� Na+��_____�� SO42- ��
��2��______mol H2O �к��е���ԭ������ 1.5 mol CO2�к��е���ԭ������ȡ�
��3���������ʵ����� NH3 �� CH4 ��ϣ���������� NH3 �� CH4 ������֮��Ϊ ______��
��4��Ҫʹ NH3�� CH4����ͬ��Ŀ��Hԭ�ӣ��� NH3�� CH4�����ʵ���֮��Ϊ_____��
��5����״���£��ܶ�Ϊ 0.75g��L -1�� NH3�� CH4 ��ɵĻ�������У�NH3���������Ϊ________���û�����������������ܶ�Ϊ________��
��6����֪ a g A �� b g B ǡ����ȫ��Ӧ���� 0.2 mol C �� d g D���� C ��Ħ������Ϊ ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ڸ���������һ���ܴ����������
A. ǿ������Һ�У�H+��NO3-��SO32-
B. pH=12����Һ�У�OH-��K+��Cl-��HCO3-
C. ���������ܷų���������Һ��һ�����ڣ�NH4+��NO3-��AlO2-��SO42-
D. 25CʱpH=7����ɫ��Һ�У�Na+��Cl-��SO42-��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҳ����������������Ϊ36.5%���ܶ�Ϊ1.20g/3��
�Ŵ�Ũ��������ʵ���Ũ���Ƕ��٣�_______________(��ʽ����)
������100mL3.00mol/L�����ᣬ������Ũ�������mL�� ______________(��ʽ����)
����Ũ�������Ƹ�ϡ������Ҫ������Щ���裨������˳����д��ţ���_____________________ ��
�ټ����װƿ����50mL��Ͳ��ȡһ�������Ũ�����ϴ�Ӣ���Һ��ϡ�͢߶��ݢ�ҡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�á�
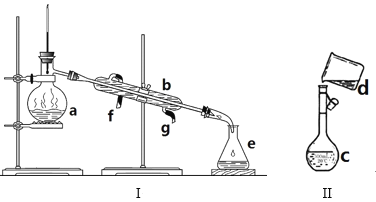
��1��д���������������ƣ�a��_____b�� _____
��2��������װ��I�������Ȼ�̼�;ƾ��Ļ�����ȱ�ٵ�������____���������������������ʵ�飬�¶ȼ�ˮ�����λ����____��������ˮ��____����f��g����ͨ�룬___��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�����ɻ���ɫ���ױ����ʶ������ȣ���仯�ɱ���Ϊ��KClO3+HCl��Ũ���DKCl+ClO2��+Cl2��+
��1������ɸû�ѧ����ʽ������ƽ���������ѧ����ʽд�ڴ���ϣ���___
��2��Ũ�����ڷ�Ӧ����ʾ������������___����д��ţ���
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��3��������7.1gCl2��������ClO2������Ϊ___g��
��4��ClO2���к�ǿ�������ԣ���˳�����������������������Ч�ʣ��õ�λ�����õ��ĵ�������ʾ����Cl2��___����С���������λ���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һ����ʵ��Ϊ�����Ŀ�ѧ������ͼʾ��ʵ�������ȷ���ǣ� ��
A.���Թ��еμ�Һ��
B.��Һ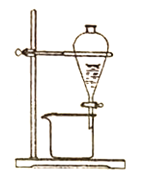
C.����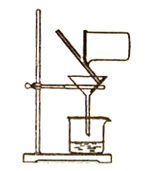
D.����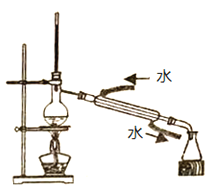
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com