
【题目】化学是一门以实验为基础的科学,下列图示的实验操作正确的是( )
A.向试管中滴加液体
B.分液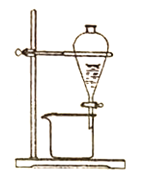
C.过滤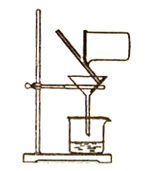
D.蒸馏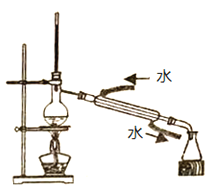
【答案】B
【解析】
A. 使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故A错误;
B. 由图中装置的仪器可知,可知本实验操作名称是分液,分离互不相溶的液体,分液时,取下分液漏斗上方的活塞,使液体顺利地下,分液漏斗下端靠近烧杯内壁,防止液体飞溅,故B正确;
C. 由图中装置的仪器,可知本实验操作名称过滤,分离难溶固体与液体的混合物,过滤时,要注意一贴,滤纸贴紧漏斗,二低,滤纸边缘低于漏斗边缘,滤液低于滤纸边缘,三靠,即烧杯靠近玻璃棒,玻璃棒靠近三层滤纸,漏斗下端靠近烧杯内壁,如果按图中漏斗下端不靠近烧杯内壁,会引起液体的飞溅,故C错误;
D. 由图中装置的仪器可知本实验操作名称蒸馏,分离沸点不同的液体混合物,温度计的位置在蒸馏烧瓶的具支管口,因为它测的是蒸汽的温度,冷凝管的进水口和出水口的位置上是下进上出,这样的冷凝效果好,故D错误;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:(已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。)
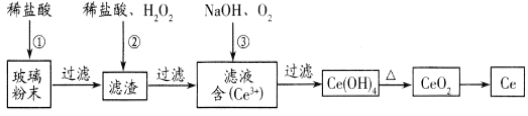
滤渣的成分是_____________________,反应②的离子方程式是_____________________________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为___________________________。
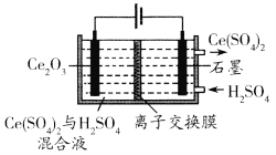
(3)利用电解方法也可以实现铈的回收。在酸性条件下电解Ce2O3(如图):阳极电极反应式为________________,离子交换膜为________ (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、_________、_________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为______g,要完成本实验该同学应称出______g NaOH。
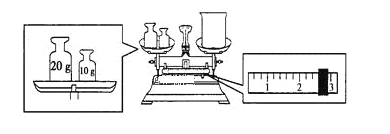
(3)使用容量瓶前必须进行的一步操作是_______________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是_____。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出图中序号①~④仪器的名称:
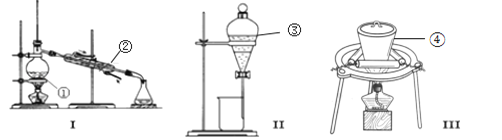
①______; ②_________; ③__________; ④__________.
(2)仪器①~④中,使用时必须检查是否漏水的有_____.(填仪器序号)
(3)分离碘水中的碘应先选择装置_____(填I、II、III) 进行操作A,再选装置_____(填I,II、III),进行_____操作(操作名称).进行操作A时,需在碘水中加一试剂,在选择试剂时,该试剂必须具备的条件是:___________________________________________________.
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.过滤 E.蒸馏 F.分液
①分离饱和食盐水与沙子的混合物_____;
②从硝酸钾和氯化钠的混合液中获得硝酸钾_____;
③分离水和汽油的混合物_____;
④分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ.(1)下列措施中可以使0.10mol·L-1 CH3COOH溶液的电离程度增大的是__________(填序号)。
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸)(填">" "<"或“=”)。
(3)某温度下,Kw=1×10-12,将 0.02mol·L-1 的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH =__________。
Ⅱ.实验表明,液态时纯硫酸的电离能力强于纯硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O![]() H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是__________
(2)25℃时,液态纯硫酸的离子积常数K(H2SO4)__________(填“>”“<”或“=”)1×10-14
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
B. 25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA
C. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D. 1mol的P4O6中含有6 NA个P-O键(P4O6的结构如图: ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
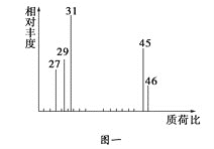
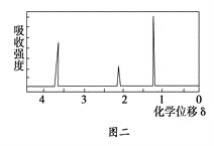
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com