
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
【答案】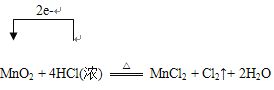 2 mol 2NA 或1.204×1024 4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+ == Cl2↑+H2O
2 mol 2NA 或1.204×1024 4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O Cl-+ClO-+2H+ == Cl2↑+H2O
【解析】
(1)![]() 中,HCl作还原剂,失去电子,MnO2作氧化剂,得到电子,单线桥法是由失电子的元素指向得电子的元素的一种方法,该反应中Mn从+4降低到+2,得到两个电子,答案为
中,HCl作还原剂,失去电子,MnO2作氧化剂,得到电子,单线桥法是由失电子的元素指向得电子的元素的一种方法,该反应中Mn从+4降低到+2,得到两个电子,答案为
(2)4molHCl参加反应,但是Cl元素化合价只有一半升高,也即2molHCl做还原剂,被氧化为1molCl2,转移2mol电子,即2NA 或1.204×1024。
(3)该反应为氧化还原反应,根据失电子数等于得电子数及有化合价升高就有化合价降低的原理可知,Cl元素的另一种产物为NaCl,从而可写出:
4Cl2+8NaOH == 6NaCl+NaClO3+NaClO+4H2O
(4)Cl-有还原性、ClO-有氧化性,在酸性条件下发生氧化还原反应生产Cl2:Cl-+ClO-+2H+ == Cl2↑+H2O


科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的SO2与SO3分子数之比为___,质子数之比为___。
(2)CO和CO2的混合气体36g,完全燃烧后测得CO2体积为22.4L(标准状况),则混合气体中CO的质量是___g;混合气体中CO2在标况下的体积是___L,混合气体在标准状况下的密度是___g/L,混合气体的平均摩尔质量是___g/mol。
(3)在一定条件下,某化合物X受热分解:2X=A+2B+4C(A、B、C均为气体),测得反应后生成的混合气体对H2的相对密度为12.22,则相同条件下,X的相对分子质量是___。
(4)由CO2、H2、CO组成的混合气在同温、同压下与氮气的密度相同。则该混合气体中CO2、H2气体的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究乙醇结构及其部分的化学性质,进行下列实验。完成下列问题:
Ⅰ.用如图装置来推测乙醇的结构式。

(1)实验中钠需要粉碎成很小的颗粒,其原因是__________。
(2)两次实验平均用乙醇1.15克,收集到气体体积平均为0.28升(换算成标准状态)。由实验数据可以推测乙醇分子的结构,依据是________。
(3)若使用的乙醇中含有少量的水,则收集到氢气的体积________。(偏大、偏小、无影响)
Ⅱ.利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(固定和夹持装置已略去)

(4)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。
(5)实验过程中D装置可以观察到的实验现象为_______。写出D处发生反应的化学方程式__________。实验进行一段时间后,如果撤去D处酒精灯,反应能否继续进行?_____。原因是_______。
(6)检验E中的生成物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1的氨水滴定20.00 mL a mol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。下列说法不正确的是

A. 图上四点对应溶液中离子种类相同
B. 若N点溶液中存在c(H+)=c(OH-)+c(NH3·H2O) ,则N点为滴定反应的恰好反应点
C. 图上四点对应的溶液中水的电离程度由大到小排列为N>P>M>Q
D. 若N点为恰好反应点,则M点溶液中存在c(Cl-)=2c(NH3·H2O)+2c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.在常温常压下,1mol氦气含有的原子数为NA
C.71gCl2所含原子数为 NA
D.23g钠在化学反应中失去电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH,常温下为液态)是一种常用的能源物质。
①甲醇的热值为23 kJ · g-1。写出甲醇燃烧热的热化学方程式:_________________________。
②以甲醇为原料设计成燃料电池:若以熔融Na2CO3作为电解质,一极充入甲醇,另一极充入空气和CO2气体。回答下列问题:
充入空气和CO2气体的电极为__________极,该电池的总反应式:_____________________,充入甲醇电极的反应式:______________________________________。
③若用该燃料电池为电源,用石墨电极电解250 mL CuSO4溶液。则与充入空气和CO2气体的电极相连的是电解池的_______极;与甲醇电极相连的电极反应式为______________________;若燃料电池中消耗0.05 mol甲醇,电解池中共产生标准状况下气体2.24 L, 则原 CuSO4溶液浓度为________mol·L-1(假设电解前后溶液体积不变)。
(2)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。写出该电解的总反应_________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法错误的个数是
①标准状况下,2.24L CH2Cl2含有的分子数为0.1 NA
②1mol苯甲酸中含有双键的数目为NA
③同温同压下,2 NA个C2H4(g)与NA个C4H8(g)的密度相等
④15g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA
A. 2个 B. 3个 C. 4个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是

A. C60属于离子晶体
B. C60摩尔质量是720
C. 在C60晶胞中平均每个晶胞有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com