
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.用250mL容量瓶等仪器配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为M molL﹣1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积V2 mL。
回答下列问题:
(1)正确的操作步骤是(填写字母)________→________→________→D→________;
(2)滴定时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________________;
(3)终点时颜色变化是_____________________;
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_____(填字母序号);
A.滴定终点读数时俯视 B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用盐酸润洗 D.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)该烧碱样品的纯度计算式是________。
【答案】C A B E 锥形瓶内颜色的变化 溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色 CD ![]() %
%
【解析】
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,正确的操作步骤是C→A→B→D→E,故答案为:C;A;B;E;
(2)滴定时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内颜色的变化,故答案为:锥形瓶内颜色的变化;
(3)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4,终点时溶液的颜色由黄色变为橙色,且半分钟内不恢复为原来的颜色,故答案为:溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(4)A、滴定终点读数时俯视,则V酸偏小,造成测定结果偏低,故A不选;B、锥形瓶水洗后未干燥,碱的物质的量不变,对实验无影响,故B不选;C、酸式滴定管使用前,水洗后未用盐酸润洗,则消耗V酸偏大,造成测定结果偏高,故C选;D、酸式滴定管在滴定前有气泡,滴定后气泡消失,则消耗V酸偏大,造成测定结果偏高,故D选;故答案为:CD;
(5)HCl+NaOH=NaCl+H2O可知,n(NaOH)=(V2-V1)×10-3L×Mmol/L× ![]() =M(V2-V1)×10-2mol,则该烧碱样品的纯度为
=M(V2-V1)×10-2mol,则该烧碱样品的纯度为 ![]() ×100%=
×100%= ![]() %,故答案为:
%,故答案为:![]() %。
%。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】水杨酸是一种重要的化工原料,可用于制备阿司匹林、水杨酸钠、水杨酰胺和奥沙拉嗪钠。其中奥沙拉嗪钠是治疗溃疡性结肠炎的常用药物。其合成路线如下所示,回答下列问题:

已知:
I. 
II.
III.NaNO2有强氧化性。
回答下列问题:
(1)有机物A中的官能团名称为________________;奥沙拉嗪钠在核磁共振氢谱中的吸收峰的峰面积之比为__________;
(2)反应②的反应类型为____________;反应③的方程式为______________________;反应④的反应类型为____________;
(3)在溶液中反应⑥所用的试剂X为___________;
(4)设计B→C步骤的目的为______________________;
(5)水杨酸有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式。
a.能发生银镜反应 b.苯环上的一氯代物有两种同分异构体___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为ω,物质的量浓度为c mol·L-1,则下列关系中不正确的是( )
A. ω=![]() B. ω=
B. ω=![]()
C. ρ=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用CO2和H2在催化剂的作用下合成甲醇,主要发生的反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H1=-53.7 kJmol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1
(1)已知化学键的键能如下:

①反应Ⅲ:CO(g)+ 2H2(g) CH3OH(g) H3=_____________。
②碳氧双键的键能为__________________。
③在某一条件下,上述反应同时发生,若反应I、Ⅱ、III的化学平衡常数分别为K1、K2、K3,则K2=____________________(用含K1、K3的形式表示)。
(2)研究表明,在催化剂存在下,CO2和H2可发生反应I和Ⅱ。某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据(甲醇选择性即转化的CO2中生成甲醇的百分数):
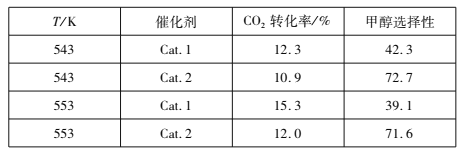
①543 K时,使用催化剂Cat.2,测得实验数据时反应I所处的状态为________________(填:“正向进行”、“平衡状态”、“逆向进行”)。
②有利于提高反应I中H2平衡转化率的措施是___________(填标号)。
A.使用催化剂Cat.1 B.降低反应温度
C.投料比不变,增加反应物的浓度 D.减小CO2和H2的初始投料比

(3)在上述反应中,混合气体CO、CO2和H2的组成关系为n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示:
①图中的压强由大到小的顺序为____________。
②α(CO)值随温度升高而变小的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳原子总数之比为_____,密度之比为_____。
(2)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,则其中CO2为____ mol。
(3)9.03×1023个NH3含___mol氢原子,在标准状况下的体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与_______个H2O分子中所含原子数相等。
(2)在一定的温度和压强下,1体积气体X2跟3体积气体Y2刚好化合生成2体积气体A,则A的化 学式可表示为________。
(3)在同温同压同体积的条件下,H2与气体B的质量之比是1:8,则B的摩尔质量为________。
(4)在25℃、101kPa的条件下,同质量的CH4和气体C的体积之比是15:8,则C的摩尔质量为_______。
(5)相同温度下在两个相同容积的密闭容器 D、E中,分别充入相同质量的X气体和CO气体,D和E中的压强之比是7:16,则X的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1mol/L的是( )
A. 将58.5g NaCl溶解在1L水中
B. 将1L 10mol/L的硫酸加入9L水中
C. 将11.2L HCl气体溶于水配成0.5L溶液
D. 将40g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为1L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com