
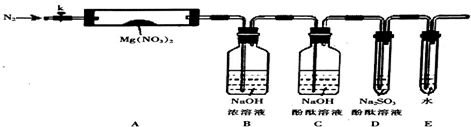
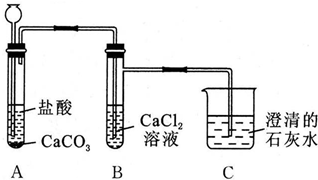
分析 实验探究Mg(NO2)2热分解的产物:实验前需要检验装置的气密性,连接仪器后,关闭k,微热硬质玻璃管A,观察到E中有气泡连续放出,证明装置气密性良好,加热前通入N2,利用氮气提供惰性环境,避免空气成分干扰,装置A:Mg(NO2)2热分解,装置B:A中出现的红棕色气体和浓氢氧化钠反应,2NO2+2NaOH=NaNO3+NaNO2+H2O,吸收二氧化氮,装置C:检验二氧化氮是否除尽,检验氨气存在,装置D:检验氧气存在,装置E:尾气吸收,防止空气中进入装置.
(1)选项中都涉及N元素的化合价的变化,为氧化还原反应,应满足氧化剂和还原剂得失电子数目相等,以此解答;
(2)①设法使装置内外形成气压差是气密性检查的常用手段,该题可利用封闭气体的热胀冷缩进行气密性检验;③丙:Mg3N2、O2,氮化镁和水反应生成氢氧化镁和氨气;
(3)①根据硝酸镁的反应现象结合固体质量差量法进行计算,确定固体的分解方式;
②D中亚硫酸钠具有还原性,能够和氧气反应生成硫酸钠,溶液褪色;二氧化氮和水和氧气生成硝酸,C中滴有酚酞NaOH,能检验二氧化氮是否除尽,便于D中检验产物氧气.
解答 解:(1)Mg(NO2)2中氮元素化合价为+5价,而丁:MgO、NO2、N2,由于产物中氮元素NO2(+4价)、N2(0价),无其它化合价变化,为化合价只有降低情况,没有升高,不满足氧化还原反应的特征,
故答案为:不符合氧化还原反应原理;
(2)①该实验连接仪器后,利用封闭气体受热体积膨胀进行检验装置的气密性,方法为:关闭k,微热硬质玻璃管A,观察到E中有气泡连续放出,证明装置气密性良好,
故答案为:连接仪器后,关闭k,微热硬质玻璃管A,观察到E中有气泡连续放出,证明装置气密性良好;
③氮化镁和水反应生成氨气、氢氧化镁,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(3)①硝酸镁分解,红棕色气体是二氧化氮,镁元素不会还是硝酸镁形式,所以甲错误,称取Mg(NO3)2固体3.7g即0.025mol置于A中,测得剩余固体的质量为1.0g,则固体减少的质量是2.7g,硝酸镁的分解反应为:2Mg(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2 MgO+4NO2↑+O2↑,乙正确,
故答案为:乙;
②亚硫酸钠和氧气的反应,反应方程式是:2Na2SO3+O2=2Na2SO4,小组讨论认定分解产物中有O2存在,未检测到的原因是,二氧化氮和水和氧气生成硝酸:4NO2+O2+2H2O=4HNO3,C中滴有酚酞NaOH的作用是:检验二氧化氮是否除尽,便于D中检验产物氧气,
故答案为:Na2SO4;4NO2+O2+2H2O=4HNO3;检验二氧化氮是否除尽,便于D中检验产物氧气.
点评 本题探究硝酸镁分解产物,提出假想,通过实验验证,涉及了化学方程式的书写、基本实验操作的考查等,本题难度中等,有利于提高学生运用所学知识的能力及化学实验能力.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3═Fe(NO3)3+3NO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向硝酸亚铁溶液中加入稀盐酸:3Fe2++2H++$NO_3^-$═3Fe3++NO↑+H2O | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2$NO_3^-$═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+,无K+ |
| D | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质 | |
| B. | 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 | |
| C. | 25℃时,Ksp( BaC03)>Ksp( BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 | |
| D. | 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
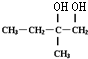
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$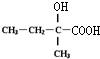 +H2O⑥
+H2O⑥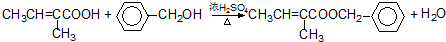
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com