
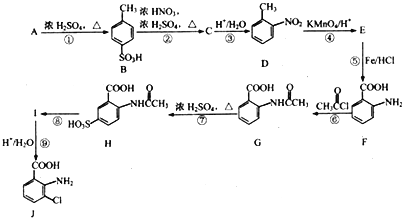
【题目】以芳香烃A(C7H8)为主要原料合成重要的医药中间体J的流程图如下:
己知:①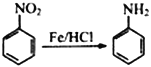 (-NH2易于被强氧化剂氧化)
(-NH2易于被强氧化剂氧化)
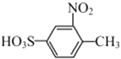
②![]()
③![]()
回答下列问题:
(1)A的结构简式为__________,其分子中不同化学环境的氢原子的个数比为__________。
(2)B→C 的化学方程式为_____________________,反应④的反应类型为__________。
(3)反应⑧所需试剂和条件为___________;E中含氧官能团的名称为_____________。
(4)反应⑥和⑦的顺序是否可以交换过来?__________(选填“是”或“否”)。分析⑥→⑨步的反应,其中反应⑥的主要目的是_____________________。
(5)K是J的同分异构体,其苯环上的取代基与J的相同但位置不同,则K可能的结构有__________种。
(6)请参照题中所示合成路线,以苯和![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线__________。合成路线示例如下:CH3CH2OH
的合成路线__________。合成路线示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
【答案】 ![]() 1∶2∶2:3
1∶2∶2:3 ![]() +HNO3
+HNO3![]()
 +H2O 氧化反应 Fe粉+Cl2气(或Fe粉+FeCl3) 硝基、羧基 否 保护氨基 9
+H2O 氧化反应 Fe粉+Cl2气(或Fe粉+FeCl3) 硝基、羧基 否 保护氨基 9 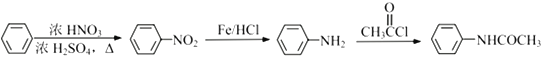
【解析】A的分子式为C7H8,明显为甲苯(![]() );A到B发生苯环的磺酸化得到B(
);A到B发生苯环的磺酸化得到B(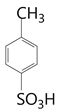 ),B到C应该发生硝化反应,根据D的结构得到硝基在甲基的邻位,所以C为
),B到C应该发生硝化反应,根据D的结构得到硝基在甲基的邻位,所以C为 ,C在酸性条件下水解去掉磺酸基(根据已知的反应②)得到D(
,C在酸性条件下水解去掉磺酸基(根据已知的反应②)得到D(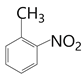 ),D经高锰酸钾氧化将甲基氧化为羧基,得到E(
),D经高锰酸钾氧化将甲基氧化为羧基,得到E( ),经Fe/HCl将硝基还原为氨基(根据已知的反应①),得到F(
),经Fe/HCl将硝基还原为氨基(根据已知的反应①),得到F(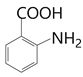 ),F与
),F与![]() 反应得到G(
反应得到G(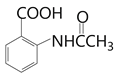 ),再与浓硫酸发生磺化反应得到H(
),再与浓硫酸发生磺化反应得到H(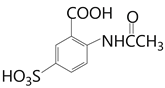 ),根据J的结构简式H要氯代,水解去掉磺酸基,根据题目已知反应②,得到I到J是水解去掉磺酸基,所以H到I是氯代,I为
),根据J的结构简式H要氯代,水解去掉磺酸基,根据题目已知反应②,得到I到J是水解去掉磺酸基,所以H到I是氯代,I为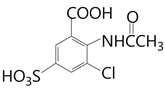 ,最后一步酸性水解去掉磺酸基和乙酰基得到J。
,最后一步酸性水解去掉磺酸基和乙酰基得到J。
(1)A的结构简式为![]() 。其分子中不同化学环境的氢原子的个数比为1∶2∶2∶3。
。其分子中不同化学环境的氢原子的个数比为1∶2∶2∶3。
(2)B到C是硝化反应,所以方程式为:![]() +HNO3
+HNO3![]()
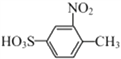 +H2O。反应④是高锰酸钾氧化甲基,所以反应为氧化反应。
+H2O。反应④是高锰酸钾氧化甲基,所以反应为氧化反应。
(3)反应⑧为苯环的氯代,所以反应的试剂和条件是氯气和铁粉(或者氯气和氯化铁)。E为, 所以其中的含氧官能团为羧基和硝基。
所以其中的含氧官能团为羧基和硝基。
(4)反应⑥和⑦的顺序是不能交换的,因为反应⑦需要浓硫酸加热反应,而浓硫酸是强化剂,可能会氧化氨基,反应⑥将氨基转化为酰胺键保护起来,这样就避免了在后续的反应中将氨基氧化。
(5)J为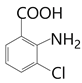 ,与J
,与J ,去掉J自己得到9种同分异构体。
,去掉J自己得到9种同分异构体。
(6)以苯和![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() ,根据最后生成物中N原子连接在苯环上,所以先进行苯环的硝化反应,再将硝基还原为氨基,再与
,根据最后生成物中N原子连接在苯环上,所以先进行苯环的硝化反应,再将硝基还原为氨基,再与![]() 取代即可,流程为:
取代即可,流程为: 。
。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
②图1为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= ____,平衡时NO的转化率为____。
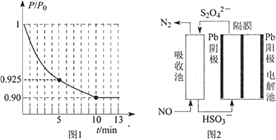
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_________。用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是( )
A. 采用电解水法制取氢气作为新能源 B. 完善煤液化制取汽油的技术
C. 研制推广以甲醇为燃料的汽车 D. 进一步提高石油加工工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应A+3B=2C+D,在某段时间内以A的浓度变化表示的化学反应速率为1 mol/(L.min),则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol/(L·min)B.1 mol/(L·min)C.2 mol/(L·min)D.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜矿石又叫孔雀石。已知碱式碳酸铜粉末不溶于水和醇,用CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,为了探究该反应得到的碱式碳酸铜的化学式,某班同学设计了如下实验:
【碱式碳酸铜的制备】
称取12.5g胆矾,研细,滴加4滴稀硫酸,溶于适量蒸馏水中,充分搅拌后得到CuSO4溶液。向其中加入适量Na2CO3溶液,充分振荡,将所得蓝绿色悬浊液静置后过滤,依次用蒸馏水、无水乙醇洗涤所得蓝绿色固体,最后低温烘干备用。
(1)配制CuSO4溶液时,滴加稀硫酸的作用是__________________________________。
(2)用无水乙醇洗涤蓝绿色固体的目的是_____________________________________。
【实验探究】
同学们设计了如下装置,用制得的蓝绿色固体进行实验。
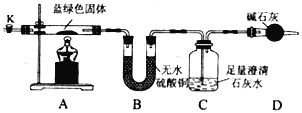
请按要求答下列问题:
(3)检查完该装置的气密性,装入药品后,实验开始前需通入一段时间气体N2,然后关闭弹簧夹K,再点燃A处酒精灯加热,控制C中导管均匀地产生气泡。通入N2的作用是____________,N2的电子式为____________。
(4)点燃A处酒精灯后,能观察到的现象是_________________________________。
(5)装置C中所发生反应的离子方程式为_____________________________________。
(6)同学们查阅文献得知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式会更好,其原因是_________________(选填下列字母代号)。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收 CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(7)若蓝绿色固体的组成为xCuCO3·yCu(OH)2。取干燥后的蓝绿色固体10.84g,煅烧至完全分解后得到8.00g固体及1.08gH2O。则该蓝绿色固体的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______________________;
(2)从开始至2min,Z的平均反应速率为___________;
(3)反应达平衡时,体系的压强是开始时的____________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。 请回答下列问题:

(1)D的化学式为_______________ 。
(2)反应③的离子方程式为________________________ 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com