
����Ŀ��ij�о�С��ͬѧͨ������������ȡ������ˮ��ϡ����ĻƼ������1KNH4Fex��OH��y��SO4��z]����ͨ��ʵ��ⶨ��Ʒ�лƼ���������й���ɣ� 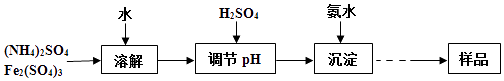
ʵ��ⶨ��
�ٳ�ȡһ����������Ʒ����ϡ�����г���ܽ⣬��������Һת��������ƿ�����Ƴ�l00mL��ҺA��
����ȡ25.00mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����4.66g��
����ȡ25.00mL��ҺA����������KI����1.000molL��1Na2S2O3��Һ���еζ�����֪��ӦΪI2+2Na2S2O3�T2NaI+Na2S4O6��������30.00mL Na2S2O3��Һ���յ㣮
��1����1KNH4Fex��OH��y��SO4��z]��x��y��z�Ĵ�����ϵʽΪ ��
��2����������Ҫ����Ҫ�������������� ��
��3��д��ʵ��ⶨ���м�������KI��Ӧ�����ӷ���ʽ ��
��4����������ʵ�����ݼ�����Ʒ�е�n��SO42������n��Fe3+������д��������̣�
���𰸡�
��1��3x+2=2y+z
��2���ձ���©����������
��3��2Fe3++2I��=I2+2Fe2+
��4��n��SO42����=n��BaSO4��= ![]() =0.02mol
=0.02mol
���������⣺��1����[KNH4Fex��SO4��y��OH��z]�У�KԪ�ػ��ϼ�+1�ۣ�NԪ�ػ��ϼ۩�3�ۣ�HԪ�ػ��ϼ�+1�ۣ�SO42�����ϼ۴�����Ϊ��2�ۣ�OH�����ϼ۴�����Ϊ��1�ۣ�+1+����3��+��+1����4++3x+����2y��+����1��z��=0��x��y��z�Ĵ�����ϵʽΪ��3x+2=2y+z��
�ʴ�Ϊ��3x+2=2y+z����2����������Ҫ����Ҫ�����������ձ���©������������
�ʴ�Ϊ|���ձ���©��������������3����ȡ25.00mL��ҺA����������KI������������ԭ��Ӧ���������Ժ������Ϊ�ⵥ�ʣ���Ӧ�����ӷ���ʽΪ��2Fe3++2I��=I2+2Fe2+��
�ʴ�Ϊ��2Fe3++2I��=I2+2Fe2+����4��25ml��Һ��������������ʵ��������ᱵ���ʵ�����ͬ��n��SO42����=n��BaSO4��= ![]() =0.02mol��
=0.02mol��
2Fe3+�� | I2�� | 2Na2S2O3 |
2 | 1 | 2 |
n��Fe3+��=2n��I2��=n��Na2S2O3��=1.000mol/L��0.03L=0.03mol��
��Ʒ�е�n��SO42������n��Fe3+��=0.02mol��0.03mol=2��3��
�ʴ�Ϊ��n��SO42����=n��BaSO4��= ![]() =0.02mol��
=0.02mol��
2Fe3+�� | I2�� | 2Na2S2O3 |
2 | 1 | 2 |
n��Fe3+��=2n��I2��=n��Na2S2O3��=1.000mol/L��0.03L=0.03mol��
��Ʒ�е�n��SO42������n��Fe3+��=0.02mol��0.03mol=2��3��
��1����������Ԫ�ػ��ϼ۴�����Ϊ0����õ�����2����Ϲ��˲���ѡ����Ҫ�IJ�����������3����ȡ25.00mL��ҺA����������KI������������ԭ��Ӧ���������Ժ������Ϊ�ⵥ�ʣ���4������25mL��Һ�������Ӻ�������������ʵ���֮�ȣ�����������������ʵ��������ᱵ���ʵ�����ͬ�����������ʵ����������ݵζ������з����Ļ�ѧ��Ӧ������ϵ���㣬2Fe3+��I2��2Na2S2O3��


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������NH4Al(SO4)2��12H2O���Ƿ�����ѧ���õĻ��Լ�����ҵ�ϳ�����������Ҫ�ɷ�ΪAl2O3�������������������Z��ˮ��Һ�������˿��������乤������ͼ���£�
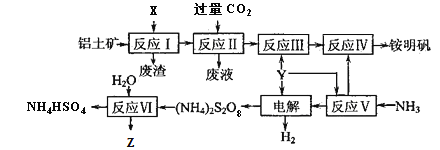
��1��д����Ӧ������ӷ���ʽ____________________��
��2��25��ʱ����0.2 mol��L-1�İ�ˮ��0.1 mol��L-1��Y��Һ�������ϣ�������Һ��pH=5������¶��°�ˮ�ĵ��볣��Kb��_____________�����Ի��ʱ��Һ����ı仯����
��3���ӷ�Ӧ�����������Һ�л������������ʵ���������Ϊ_____________��____________�����ˡ�ϴ�ӣ���������ƣ���
��4������⡱ʱ���ö��Բ������缫���������缫��ӦʽΪ__________________________��
��5����Ӧ���Ļ�ѧ����ʽΪ______________________��
��6����ˮ�к���Fe2����Mn2+�Ƚ������Ӷ���Ȼ���������ص��ƻ����ã�������(NH4)2S2O8������ȥ��д��Mn2+����������MnO2�����ӷ���ʽΪ__________________________________��ZҲ�н�ǿ�����ԣ���ʵ�������в���Z����Mn2+��ԭ����_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ʵ���Ҳ�����ͼ��ʾװ���Ʊ�����������ʵ�������ȡ��ʢ�б���̼������Һ���Թܣ����ظ��Թ��ڱڻ���������ɫʯ����Һ1������������ɫʯ����Һ�����ڱ���̼������Һ������������Һ��֮��(�������̲����Թ�)�������йظ�ʵ�������������ȷ����( )

A���Ʊ������������л���������Ҵ�����
B����ʵ����Ũ����������Ǵ�����ˮ
C������̼������Һ��Ҫ�����ǽ��������������ܽ�ȼ������Ҵ����к�����
D��ʯ���Ϊ���㻷�����϶����������ϡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܽ�����ת���ɻ�ѧ�ܵ����� ��
A. ˮ������ B. ��ƿ������ C. �ֻ���� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������к��еĻ�ѧԪ���������ٵ���
A. ��������� B. ��ά�غ��������� C. �Լ��غ�Ҷ���� D. ATP��ø
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ�������
A.��CHO�ĵ���ʽ�� ![]()
B.������ӵı���ģ��Ϊ�� ![]()
C.2���һ���1��3������ϩ�ļ���ʽ�� ![]()
D.�������ױ��Ľṹ��ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ������������������о���������Ҫ����;����ͼ�Ǵ����������Ʊ����Ĺ������̣�

��֪����1�����������Ҫ�ɷ���Al2O3�������������SiO2��Fe2O3�����ʣ�
��2����Һ�еĹ�������ƫ�����Ʒ�Ӧ�������ɹ������γ�������ѧ��Ӧ����ʽΪ2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8��+4NaOH����ش��������⣺
��1����������Al2O3������������Һ��Ӧ�����ӷ���ʽΪ_________________________________��
��2���ڹ��������С��ữ��ʱ��������������B��________��������_______________________��д���ữ���̷�����Ӧ�Ļ�ѧ����ʽ��________________________________��
��3����ҵ����Al2O3��C��Cl2�ڸ��������·�Ӧ��ȡAlCl3��������ÿ����6.0 g̼���ʣ�ת��1 mol���ӣ���Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4��ijͬѧ�Ʋ������������������ȷ�Ӧ�õ����������л�����Fe2O3����������·�������֤��ȡһ���������Ͷ������ϡ�����У���Ӧһ��ʱ�����Ӧ��Ļ��Һ�еμ����ʼ���Һ���۲���Һ��ɫ�ı仯������֤�����������Ƿ���Fe2O3��
�����ʼ���_________(�ѧʽ)�����жϸ�ͬѧ��Ƶ�ʵ�鷽���ĺ�����_________(�������������������ԭ����_______________________________________����������������д����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H���������о���һЩ��ѧ���ļ������ݣ�������ʹ��
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
��ҵ�ϵĸߴ����ͨ�����з�Ӧ��ȡ��SiCl4��g��+2H2��g��Si��s��+4HCl��g�����÷�Ӧ���淴Ӧ�ġ�HΪ ( )
A. ��236 kJmol��1 B. ��412 kJmol��1 C. +236 kJmol��1 D. +412 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʷ��ÿһ���ش��ֶ�������ƽ��˿�ѧ�ķ�չ���Ž��з�Ի�ѧ�Ĺ������ڣ� ��
A.��ȡ����űҩ��������
B.�����˺ϳɰ�����������
C.��ʾ��ȼ�յı���
D.�����Ԫ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com