
【题目】下列物质不能通过化合反应直接制得的是
A.FeCl2B.NaHSO3C.Al(OH)3D.Fe(OH)3
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( ) 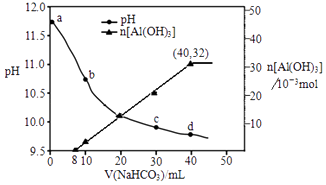
A.NaHCO3溶液的物质的量浓度为0.8 mol/L
B.b点与c点溶液所含微粒种类相同
C.a点溶液中存在的离子是Na+、AlO2﹣、OH﹣、H+
D.生成沉淀的离子方程式为:HCO3﹣+AlO2﹣+H2O═Al(OH)3↓+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl2、CuCl广泛用于有机合成的催化剂.CuCl2容易潮解; CuCl白色粉末,微溶于水,溶于浓盐酸和氨水生成络合物,不溶于乙醇. 已知:i.CuCl2+Cu+2HCl(浓)2H[CuCl2](无色) ![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
ii.副反应:CuCl+H2OCuOH+2HCl; CuCl+Cl﹣═[CuCl2]﹣
(1)制取CuCl2装置如图: 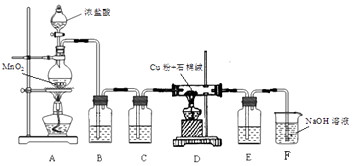
①A装置中发生反应的离子方程式是 .
②C、E 装置中盛放的是浓硫酸,作用是 .
③B中选择饱和食盐水而不用蒸馏水的原因是 .
(2)制取CuCl流程如图: 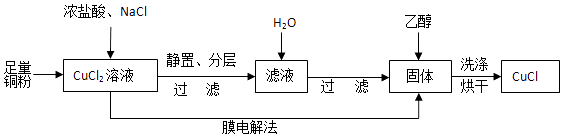
①反应①中加入NaCl的目的是;但是Cl﹣浓度过高,CuCl产率降低,原因是 .
②CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的方程式为 .
③利用膜电解法制取CuCl,阴极电极反应式为 .
④用乙醇洗涤沉淀Y的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 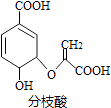
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y,Z,Y,Z经催化加氢后都可得到2甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH
B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH
D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
A.过量的氢气与氮气
B.过量的浓盐酸与二氧化锰
C.过量的铜与浓硫酸
D.过量的锌与18 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100ml某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 , 充分反应后,向所得溶液中逐滴滴入1mol/L的盐酸溶液,所得气体的体积(标准状态)与所加盐酸的体积关系如图所示
(1)写出OA+段发生反应的离子方程式:。
(2)反应到B点时所得溶液中的溶质是。
(3)原NaOH溶液的物质的量浓度是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
Ⅰ.在废液中加入过量铁粉,过滤;
Ⅱ.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ.合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ.…,得到FeCl36H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 .
(2)试剂A是 .
(3)步骤Ⅲ中发生的离子方程式为 .
(4)完成步骤Ⅳ需要用到的实验装置是(填字母). 
(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液
①用托盘天平称FeCl36H2O晶体,其质量是g.
②实验时下图所示操作的先后顺序为(填编号).
蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的可以实现或操作正确的是
A. 用托盘天平称取3.23gNaCl固体
B. 用10mL量筒量取7.50mL稀盐酸
C. 蒸馏时冷凝聚管中冷却水流向是上口进下口出
D. 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com