
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
Ⅰ.在废液中加入过量铁粉,过滤;
Ⅱ.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
Ⅲ.合并Ⅰ和Ⅱ中的滤液,通入足量氯气;
Ⅳ.…,得到FeCl36H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 .
(2)试剂A是 .
(3)步骤Ⅲ中发生的离子方程式为 .
(4)完成步骤Ⅳ需要用到的实验装置是(填字母). 
(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液
①用托盘天平称FeCl36H2O晶体,其质量是g.
②实验时下图所示操作的先后顺序为(填编号).
蒸馏水
【答案】
(1)2Fe3++Cu═2Fe2++Cu2+
(2)盐酸
(3)2Fe2++Cl2=2Fe3++2Cl﹣
(4)ab
(5)13.5;④⑥③⑤②①
【解析】解:用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2 . Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2 , 与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;Ⅲ.I和II中的滤液中均为FeCl2 , 通入足量氯气,反应生成FeCl3;Ⅳ.…,得到FeCl36H2O晶体.(1)铜与氯化铁反应生成氯化铁、氯化亚铁,化学反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+ , 故答案为:2Fe3++Cu═2Fe2++Cu2+;(2)试剂A只能将铁反应掉,不和铜反应,且不能引入杂质离子,故A为盐酸,故答案为:盐酸;(3)III中的溶液中为FeCl2 , 通入足量氯气,将FeCl2反应生成FeCl3 , 反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣ , 故答案为:2Fe2++Cl2=2Fe3++2Cl﹣;(4)由FeCl3溶液得FeCl36H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤,故选ab,故答案为:ab;(5)①若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液,氯化铁物质的量=0.1L×0.5mol/L=0.05mol,则晶体物质的量为0.05mol,需要称量的固体质量=0.05mol×270.5g/mol=13.525g≈13.5g,故答案为:13.5;②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤转入、定容、摇匀等操作得到,实验时下图所示操作的先后顺序为④⑥③⑤②①,故答案为:④⑥③⑤②①;
用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2 . Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2 , 与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;Ⅲ.I和II中的滤液中均为FeCl2 , 通入足量氯气,反应生成FeCl3;Ⅳ.…,得到FeCl36H2O晶体.据此分析,(1)铜与氯化铁反应生成氯化铁、氯化亚铁;(2)试剂A只能将铁反应掉,不和铜反应,且不能引入杂质离子;(3)III中的溶液中为FeCl2 , 通入足量氯气,将FeCl2反应生成FeCl3;(4)由FeCl3溶液得FeCl36H2O晶体的方法是加热蒸发、浓缩结晶,然后过滤;(5)若用FeCl36H2O晶体配制100ml 0.5mol/L的FeCl3溶液,氯化铁物质的量=0.1L×0.5mol/L=0.05mol,则晶体物质的量为0.05mol,计算得到称量的质量,托盘天平称量到0.1g,配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤转入、定容、摇匀等操作得到;


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的N2和CO2
D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化关系如图所示,反应过程中部分产物可能已略去。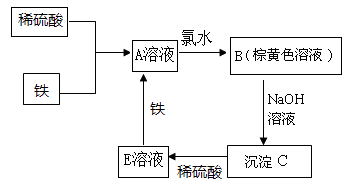
请回答以下问题:
(1)E溶液中溶质的化学式为。若将沉淀C加热至恒重,最终得到的物质是。
(2)A溶液中滴加入NaOH溶液,振荡,放置一段时间,可以观察到的现象是 , 发生反应的化学方程式有。
(3)若在酸性的A溶液中通入氧气,也能得到棕黄色溶液,请写出此反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm之间 B. 都能产生丁达尔效应
C. 加入浓氢氧化钠溶液都产生红褐色沉淀 D. 颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将29.6g碳酸钠和碳酸氢钠的混合物加热到质量不再减少为止,冷却,称得固体质量为26.5g。问:原固体混合物中碳酸氢钠的质量是多少?把原固体混合物与足量盐酸完全反应生成的CO2在标准状况下的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是
A.将40gNaOH 溶解在1L水中
B.将22.4LHCl气体溶于水配成1 L溶液
C.将1L 10 mol/L的浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com