
【题目】食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42﹣等杂质离子,实验室提纯NaCl的流程如图: 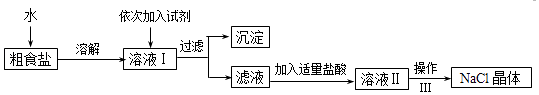
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)从上述提供的试剂中选出适当的试剂除去溶液I中的Ca2+、Mg2+、SO42﹣离子,滴加顺序依次为、、(只填化学式).
(2)操作Ⅲ的名称是 , 所需用到的仪器主要有铁架台、酒精灯、铁圈、(填仪器名称).
(3)加盐酸的目的是(用离子方程式表示)、 .
【答案】
(1)NaOH;BaCl2;Na2CO3
(2)蒸发结晶;蒸发皿、玻璃棒
(3)H++OH﹣=H2O;2H++CO32﹣=H2O+CO2↑
【解析】解:(1)要除去SO42﹣ , 只有选BaCl2溶液,若选用Ba(NO3)2 , 会引入新的离子NO3﹣ , 再选用NaOH溶液除去Mg2+溶液,最后选用Na2CO3溶液除去Ca2+ , 此处不能选用K2CO3溶液,否则会引入新的K+ , 再用HCl除去过量的CO32﹣ , Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+ , 所以答案是:BaCl2、NaOH、Na2CO3或NaOH、BaCl2、Na2CO3;(2)得到NaCl晶体,需要蒸发结晶操作,该装置所需用到的仪器主要有铁架台、酒精灯、铁圈、蒸发皿、玻璃棒;所以答案是:蒸发结晶;蒸发皿、玻璃棒;(3)加入盐酸除去NaOH和碳酸钠,离子方程式为H++OH﹣=H2O、2H++CO32﹣=H2O+CO2↑,
所以答案是:H++OH﹣=H2O;2H++CO32﹣=H2O+CO2↑.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】酸性溶液中,Fe2+会被空气缓慢氧化为Fe3+。不同条件下,一定浓度的Fe2+的氧化率随时间变化关系如下图所示。下列有关说法正确的是

A. 该氧化过程的离子方程式为:Fe2++O2+4H+=Fe3++2H2O
B. pH=1.5时Fe2+的氧化率一定比pH=2.5时大
C. Fe2+的氧化率仅与溶液的pH和温度有关
D. 其他条件相同时,80℃时Fe2+的氧化率比50℃时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】15.8g KMnO4氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl,反应方程式如下:2KMnO4 + 16HCl =2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O。
(1)该盐酸中HCl的物质的量浓度是______________________________。
(2)被氧化的HCl的物质的量为________________________。
(3)求产生的Cl 2在标准状况下的体积(依据化学方程式进行计算,要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu3P中P为﹣3价,在反应 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中,
①被氧化的P和被还原的P的物质的量之比为;
②上述反应中7.5mol CuSO4氧化的P原子的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学学习和研究的说法错误的是( )
A.化学模型有助于解释一些化学现象B.质量守恒定律是大量实验事实的总结
C.化学家提出的假设都能被实验证明D.化学基本原理的应用是有一定条件的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,挪威和荷兰正在开发一种新能源﹣﹣盐能.当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%,海水和淡水混合时,温度升高最可能的原因是( )
A.由于浓度差产生放热
B.发生了水分解反应
C.发生了盐分解反应
D.盐的溶解程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家质检部门检出人们端午节包粽子的“返青粽叶”多以胆矾(化学式为CuSO4·5H2O)为添加剂,长期食用有害健康,请问胆矾是一种( )
A. 氧化物B. 盐C. 碱D. 酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com