
【题目】在溶液中能大量共存的一组离子或分子是( )
A. NH4+、H+、NO3-、Fe2+ B. K+ 、Al3+、SO42-- 、NH3·H2O
C. Na+、K+、SO32-、Cl2 D. Na+ 、Cl-、CO32-、OH-
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
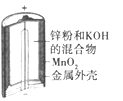
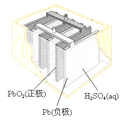
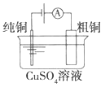
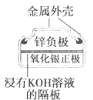
(a)碱性锌锰电池 (b)铅硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A.图(a)所示电池中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,硫酸浓度不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2存在以下反应:As2S3(s)+3S2(aq)![]() 2
2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_______________________。
(2)“一级沉砷”中FeSO4的作用是_____________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×106 g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1 g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为___________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×105 g·kg1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,是图中●、○中的一种。图中●、○分别指代哪种粒子_____________;

(2)H2S和H2O2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2S | 187 | 202 | 2.6 |
H2O2 | 272 | 423 | 以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因________________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有____________________(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有___________________。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4H2O晶体。实验中所加C2H5OH的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[一lg c(M2+)]与溶液pH的变化关系如图所示,已知该温度下,Ksp[Cu(OH)2]2],下列说法正确的是 ( )

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):C(Cu2+):1:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量Cu0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含有Na+、Ba2+、Al3+、Fe3+、Br-、CO32-等离子,取少量溶液往其中滴加氯水,有无色无味气体产生,溶液仍为无色;另取少量逐滴滴入NaOH 溶液至过量,无现象。关于该溶液的推测正确的是
A. 溶液中可能存在A13+ B. 溶液中可能存在Br-
C. 溶液中一定存在CO32- D. 溶液中可能存在Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:___________________。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲: 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com