
【题目】下列有关钢铁的腐蚀和防护的说法中正确的是
A. 钢铁的析氢腐蚀和吸氧腐蚀负极反应相同,正极反应不同
B. 镀锌铁皮和镀锡铁皮破损后,前者更易被腐蚀
C. 将铁件与电源正极相连,可实现电化学保护
D. 将钢管与铜管堆放在一起,可保护钢管少受腐蚀
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是

A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
【答案】B
【解析】由图象可知N→M发生Al(OH)3+OH-===AlO2-+2H2O,设氢氧化钠溶液浓度为c,则消耗氢氧化钠0.01cmol,n[Al(OH)3]=n(AlCl3)=0.01cmol;ON消耗氢氧化钠0.05cmol,分别发生MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知n(MgCl2)=(0.05cmol-0.01c×3mol)/2=0.01cmol,则c(AlCl3):c(MgCl2)=1:1,M点时溶液成分为NaAlO2,之后继续加入溶液后沉淀质量逐渐增大,此时应加入盐酸,发生反应为:NaAlO2+HCl+H2O= Al(OH)3↓+NaCl,继续加入盐酸沉淀逐渐溶解,生成氯化镁、氯化铝和氯化钠,则消耗的氢氧化钠和HCl的物质的量相等,A.根据分析可知,N点时溶液中的溶质只有NaCl,A正确;B.原混合溶液中c(MgCl2):c(AlCl3)=1:1,B错误;C.由横坐标可知消耗盐酸和氢氧化钠的体积相同,则二者物质的量浓度相同,C正确;D.根据分析可知,M点之前加入的是NaOH溶液,M点之后加入的是盐酸,D正确;答案选B。
【题型】单选题
【结束】
16
【题目】证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是
①先滴加氯水,再滴加KSCN溶液后显红色
②先滴加KSCN溶液,不显红色,再滴加氯水后显红色
③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
④只需滴加KSCN溶液
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:

已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②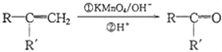 +CO2
+CO2
③RCOCH3+R'CHO![]() RCOCH=CHR'+H2O
RCOCH=CHR'+H2O
回答下列问题:
(1)A生成B的反应类型为__________,由D生成E的反应条件为_______________。
(2)H中含有的官能团名称为______________。
(3)I的结构简式为__________________________。
(4)由E生成F的化学方程式为____________________________________________。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:___________________。
①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验:
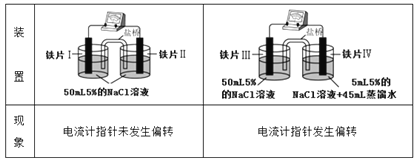
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,不能说明乙酸是弱电解质的是
A. 常温时,测得乙酸钠溶液的pH>7
B. 常温时,测得0.1 mol·L-1乙酸溶液的pH约为3
C. 乙酸溶液与大理石反应产生气泡
D. 相同温度下,测得同物质的量浓度的乙酸溶液的导电性比盐酸溶液弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
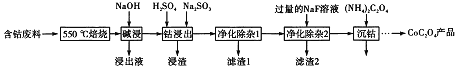
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com