
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
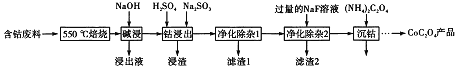
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
【答案】 除去碳和有机物 NaAlO2(NaAlO2和NaOH、Ca(OH)2也可得分) 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Fe(OH)3(答Fe(OH)3和CaSO4与CaCO3中任意一种或两种都给分) 7.0×10-6mol/L 当滴加最后一滴酸性高锰酸钾,溶液由无色变为浅红色,且半分钟内不变色 95.55%
【解析】(1)含钴废料中含有碳及有机物,“500℃煅烧”可以除去碳和有机物,故答案为:除去碳和有机物;
(2)含钴废料中含有Co2O3,少量Fe2O3、、CaO、MgO、碳及有机物等,其中Al2O3能够溶于氢氧化钠溶于,CaO 能够与水反应,因此“浸出液”的主要成分为NaAlO2和NaOH、Ca(OH)2,故答案为:NaAlO2和NaOH、Ca(OH)2;
(3)“钴浸出”过程中,Co3+被亚硫酸钠还原为Co2+,反应的离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+,故答案为:2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,双氧水具有氧化性,能够将“钴浸出”过程中被还原生成的亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,再升温至80~85℃,加入Na2CO3溶液,调pH至5,使铁离子沉淀,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3;
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,根据Ksp(CaF2)=1.05×10-10,则c(F-)=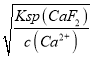 =
=![]() =
=![]() ,再根据Ksp(MgF2)=7.35×10-11,c(Mg2+)=
,再根据Ksp(MgF2)=7.35×10-11,c(Mg2+)=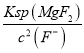 =
=![]() =7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
=7.0×10-6mol/L,故答案为:7.0×10-6mol/L;
(6)设样品中含CoC2O4质量为x,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,草酸根守恒可得:
5CoC2O4-5(NH4)2C2O4-5H2C2O4-2MnO4-
147g×5 2mol
x0.1000mol/L×0.026L
![]() =
=![]() ,解得x=0.9555g,样品纯度=
,解得x=0.9555g,样品纯度=![]() ×100%=95.55%,故答案为:95.55%。
×100%=95.55%,故答案为:95.55%。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 常温常压下,28g N2所含有的原子数为NA
B. 标准状况下,22.4 LSO3中含有的原子数为4NA
C. 1L 1.0 mol/L碳酸钠溶液中所含阳离子的数目为2NA
D. 46gNO2和N2O4的混合气体中含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,因发生氧化还原反应而不能大量共存的是
A. K+、H+、Fe2+、MnO4-B. Fe3+、Ba2+、SO42-、NO3-
C. Al3+、Na+、SO42-、CO32-D. Fe3+、H+、SO42-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中不能得到氢氧化铝沉淀的是 ( )
A. 硫酸铝溶液与过量的氨水混合B. 氯化铝溶液中加入几滴烧碱溶液
C. 偏铝酸钠溶液中加入过量的盐酸D. 偏铝酸钠溶液中通入过量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,不属于氧化还原反应的是__________(填代号,下同),H 2 O 2 仅体现还原性的反应是__________。
(2)上述反应说明H2O2 、Ag2O、K2CrO 4 氧化性由强到弱的顺序是_________________
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4— 、H2O、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
①反应体系选择的酸是:____________ A.盐酸 B.硫酸 C醋酸
②该反应的离子方程式为________________________________________。
③如果上述反应中有2.24L(标准状况)气体生成,转移的电子为 _______mol.
(4)H2O2 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2 +H2O=A+NH3↑,试指出生成物A的化学式为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烃A为主要原料,采用以下路线合成药物X、Y和高聚物Z。
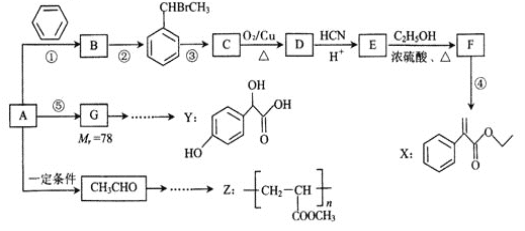
已知:

Ⅱ.反应①、反应②、反应⑤的原子利用率均为100%。
请回答下列问题:
(1)B的名称为______________。
(2)X中的含氧官能团名称为____,反应③的条件为_______,反应③的反应类型是_________。
(3)关于药物Y 的说法正确的是_________________。
的说法正确的是_________________。
A.药物Y的分子式为C8H804,遇氯化铁溶液可以发生显色反应
B.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
C.1mol药物Y与足量的钠反应可以生成33.6 L氢气
D.药物Y中⑥、⑦、⑧三处- OH的电离程度由大到小的顺序是⑧>⑥>⑦
(4)写出反应E-F的化学方程式_____________________________________。
(5)写出符合下列条件的E的所有同分异构体的结构简式________________________。
①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。
(6)设计一条以CH3CHO为起始原料合成Z的线路(无机试剂及溶剂任选) ___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A. 5 mol/L B. 7 mol/L C. 10mol/L D. 12 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com