
【题目】下列粒子半径大小的比较正确的是( )
A. Al 3+<O2- B. Cl->Br-
C. Mg<Al D. K<Na
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 40K与40Ca原子中的中子数相等
B. 互为同位素的两种原子,它们原子核内的质子数一定相等
C. 人们发现了112种元素,即共有112种原子
D. 原子结构模型演变历史可以表示为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。A可发生如图所示的一系列化学反应,其中①、②、③属于同种反应类型。请回答下列问题:
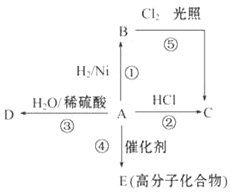
(1)写出A、B、C、D的结构简式:A____________、B___________、C__________、D_________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② ______________________________________,反应类型:__________________________。
⑤ ______________________________________,反应类型:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoC2O4是制备金属钴的原料。利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
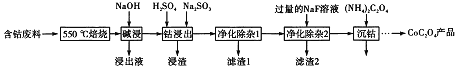
(1)“500℃煅烧”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_________。
(4)“净化除杂1”过程中,需在40~50℃ 加入H2O2溶液,其目的是_____________。
(用离子方程式表示);再升温至80~85℃,加入Na2CO3溶液,调pH至5,“滤渣I”的主要成分是___________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×10-5mol/L,则c(Mg2+)为________[已知Ksp(MgF2)=7.35×10-11”、 Ksp(CaF2)=1.05×10-10]
(6)为测定制得的CoC2O4产品的纯度,现称取1.00g样品,将其用适当试剂转化为草酸铵[(NH4)2C2O4〕溶液,再用过量稀硫酸酸化,用0.1000mol/L高锰酸钾溶液滴定,当_________时,即达到滴定终点,共用去高锰酸钾溶液26.00mL,该产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CH4在恒压密闭容器中发生反应:CH4(g)![]() C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:
C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:

(1)已知甲烷、碳、氢气的燃烧热分别为890.31kJ/mol、395.00kJ/mol、285.80kJ/mol,则该反应的反应热△H=__________。
(2)下列能说明反应一定达到平衡状态的是_______。
a.H2和CH4的体积分数相等 b.混合气体的平均相对分子质量不变
c.混合气体的密度不变 d.气体总压强不再变化
e.碳的质量不再改变
(3)T2℃时,若在平衡体系中充入惰性气体,此时反应速率________(填“变大”、“变小”或“不变”),且v正_______v逆(填“>”、“<”或“=”)。
(4)T4℃时,若在平衡体系中充入等体积的H2和CH4,则平衡_____移动,其理由是_______。
(5)T3℃时,反应达平衡后CH4的转化率为____________。
(6)CH4能催化重整转化为CO和H2,下图是一种熔融碳酸盐燃料电池示意图,电极A上CO参与电极反应方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol
NO2(g)═![]() N2O4(g) △H=-28.5kJ/mol
N2O4(g) △H=-28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式_____________。
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=____________;达到平衡时NO2转化率=____________;计算该温度下该反应的化学平衡常数K= _____________(填数值)。
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H
CO(NH2)2(s)+H2O(g) △H
该反应在一定条件下能自发进行的原因是____________;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是_____________(填序号)。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
C.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用如图所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95%以HCO3-存在),有利于减少环境中温室气体含量。

①a室的电极反应式为___________________。
②b室中提取CO2的反应的离子方程式为 ___________________。
③b室排出的海水(pH <6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com