
【题目】某烃A是有机化学工业的基本原料。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。A可发生如图所示的一系列化学反应,其中①、②、③属于同种反应类型。请回答下列问题:
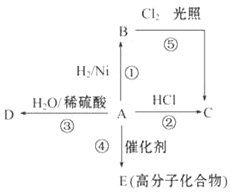
(1)写出A、B、C、D的结构简式:A____________、B___________、C__________、D_________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② ______________________________________,反应类型:__________________________。
⑤ ______________________________________,反应类型:__________________________。
【答案】 CH2=CH2 CH3-CH3 CH3CH2Cl CH3CH2OH CH2=CH2+HCl→CH3CH2Cl 加成反应 CH3-CH3+Cl2![]() CH3CH2Cl +HCl 取代反应
CH3CH2Cl +HCl 取代反应
【解析】烃A的产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,所以A为乙烯;结合流程可得:B为乙烷、C为氯乙烷、D为乙醇、E为聚乙烯。
(1)A、B、C、D的结构简式依次为:CH2=CH2、CH3-CH3、CH3CH2Cl、CH3CH2OH。
(2)反应②表示乙烯与HCl生成CH3CH2Cl,化学方程式为:CH2=CH2+HCl→CH3CH2Cl,属于加成反应;反应⑤表示乙烷与Cl2光照条件生成氯乙烷和HCl,化学方程式为:CH3-CH3+Cl2![]() CH3CH2Cl +HCl,属于取代反应。
CH3CH2Cl +HCl,属于取代反应。


科目:高中化学 来源: 题型:
【题目】将金属钙置于空气中充分燃烧,然后向所得固体产物中加入一定量蒸馏水,观察到剧烈反应,产生大量的热,并且放出有臭味的气体。对此,化学兴趣小组的同学们在老师的指导下进行了探究。
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2,H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成________。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:________。
(3)丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是_______________;
假设3:产生臭味的气体是____________________。
【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作 | 预期现象 | 结论 |
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用________、________在短时间内快速检测产生的气体。 | __________ | 假设1成立 |
__________ | 假设2成立 | |
_________ | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生将一小块金属钾投入滴有酚酞的水中,这种操作能证明下述四点性质中的( )
①钾比水轻;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液显碱性
A. 仅①④B. 仅④C. 除②外D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN—+8OH—+5Cl2 = 2CO2+N2+10Cl—+4H2O。下列判断正确的是 ( )
A. 当有0.2mol CO2生成时,溶液中阴离子的物质的量增加![]()
B. 该反应中,每有2molCN—反应,转移电子为![]()
C. 上述反应中的还原剂是![]()
D. 还原性:Cl—>CN—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )

A. 原溶液中一定含有的阳离子是H+、NH4+、Fe3+、Al3+
B. 原溶液中一定含有SO42-
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
②根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
③二氧化碳通入硅酸钠溶液中可以制得硅酸
④二氧化硅常被用来制造光导纤维
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期主族元素A、B、C、D、E,其中A为地壳中含量最高的金属元素,B元素原子的M层电子数为最内层电子数的2倍,C的气态氢化物的水溶液呈碱性,D元素的最外层电子数是电子层数的3倍,E的单质为黄绿色气体,是制备漂白粉的原料。
请回答下列问题:
(1)D元素在周期表中的位置:______.
(2)A、D、E元素简单离子半径由大到小的顺序为________________(用微粒符号填).
(3)F与D同主族且相邻,其气态氢化物稳定性由大到小为___________(填化学式).
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式______,该阳离子中存在的化学键有______.
(5)C元素的简单气态氢化物与E元素的单质反应有白烟生成,化学方程式为______.
(6)B的单质与强碱反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
⑴ ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
⑵ 表中2 mol·L-1氨水的质量分数为:________。
⑶ 将4 mol·L-1的氨水与2 mol·L-1的氨水等质量混合,所得氨水的物质的量浓度是_____(填序号)。
A.>3 mol·L-1 B.=3 mol·L-1 C.<3 mol·L-1 D.无法判断
⑷ 将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______(填序号)。
A.>15% B.=15% C.<15% D.无法判断
⑸ 100g浓度为4 mol·L-1的硫酸溶液与_________mL水混合,能使硫酸的物质的量浓度减小到2 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com