
【题目】有短周期主族元素A、B、C、D、E,其中A为地壳中含量最高的金属元素,B元素原子的M层电子数为最内层电子数的2倍,C的气态氢化物的水溶液呈碱性,D元素的最外层电子数是电子层数的3倍,E的单质为黄绿色气体,是制备漂白粉的原料。
请回答下列问题:
(1)D元素在周期表中的位置:______.
(2)A、D、E元素简单离子半径由大到小的顺序为________________(用微粒符号填).
(3)F与D同主族且相邻,其气态氢化物稳定性由大到小为___________(填化学式).
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的电子式______,该阳离子中存在的化学键有______.
(5)C元素的简单气态氢化物与E元素的单质反应有白烟生成,化学方程式为______.
(6)B的单质与强碱反应的离子方程式为______.
【答案】 第二周期第ⅥA族 Cl->O2->Al3+ H2O>H2S ![]() 极性共价键 8NH3 +3Cl2 = 6NH4Cl+N2 Si+2OH—+H2O=SiO32—+2H2↑
极性共价键 8NH3 +3Cl2 = 6NH4Cl+N2 Si+2OH—+H2O=SiO32—+2H2↑
【解析】短周期主族元素A、B、C、D、E,其中A为地壳中含量最高的金属元素,A为Al元素;B元素原子的M层电子数为最内层电子数的2倍,B为Si元素;C的气态氢化物的水溶液呈碱性,C为N元素;D元素的最外层电子数是电子层数的3倍,D为O元素;E的单质为黄绿色气体,是制备漂白粉的原料,E为Cl元素。
(1)D为O元素,在周期表中位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)一般而言,离子的电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,A、D、E元素简单离子半径由大到小的顺序为Cl->O2->Al3+,故答案为:Cl->O2->Al3+;
(3)F与D同主族且相邻,F为S元素,元素的非金属性越强,气态氢化物越稳定,气态氢化物稳定性由大到小为H2O>H2S,故答案为:H2O>H2S;
(4)用高能射线照射含有10电子的O元素氢化物分子时,一个水分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,该阳离子为H2O+,电子式为![]() ,该阳离子中存在的化学键有极性共价键,故答案为:
,该阳离子中存在的化学键有极性共价键,故答案为: ![]() ;极性共价键;
;极性共价键;
(5)C为N元素,E为Cl元素,氨气遇氯化氢气体能够反应生成氯化铵白烟,反应化学方程式为8NH3 +3Cl2 = 6NH4Cl+N2,故答案为:8NH3 +3Cl2 = 6NH4Cl+N2;
(6)B为Si元素;硅与强碱反应的离子方程式为Si+2OH—+H2O=SiO32—+2H2↑,故答案为:Si+2OH—+H2O=SiO32—+2H2↑。


科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步反应直接完成的是( )
A. Al→Al3+ B. Al→ [Al(OH)4]-
C. Al2O3 →Al(OH)3 D. Al2O3 →[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。A可发生如图所示的一系列化学反应,其中①、②、③属于同种反应类型。请回答下列问题:
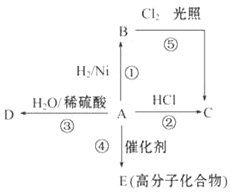
(1)写出A、B、C、D的结构简式:A____________、B___________、C__________、D_________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② ______________________________________,反应类型:__________________________。
⑤ ______________________________________,反应类型:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CH4在恒压密闭容器中发生反应:CH4(g)![]() C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:
C(s) + 2H2(g)。平衡时,体系中各气体体积分数与温度的关系如图所示:

(1)已知甲烷、碳、氢气的燃烧热分别为890.31kJ/mol、395.00kJ/mol、285.80kJ/mol,则该反应的反应热△H=__________。
(2)下列能说明反应一定达到平衡状态的是_______。
a.H2和CH4的体积分数相等 b.混合气体的平均相对分子质量不变
c.混合气体的密度不变 d.气体总压强不再变化
e.碳的质量不再改变
(3)T2℃时,若在平衡体系中充入惰性气体,此时反应速率________(填“变大”、“变小”或“不变”),且v正_______v逆(填“>”、“<”或“=”)。
(4)T4℃时,若在平衡体系中充入等体积的H2和CH4,则平衡_____移动,其理由是_______。
(5)T3℃时,反应达平衡后CH4的转化率为____________。
(6)CH4能催化重整转化为CO和H2,下图是一种熔融碳酸盐燃料电池示意图,电极A上CO参与电极反应方程式为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,根据上述内容回答下列问题:
①蛋白质在人体内最终的水解产物是_________________。
②属于人体所需微量元素的是____________________。
③属于脂溶性维生素的是_________________。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①硅酸盐产品在生活中使用广泛,下列不是硅酸盐产品的是 _______________。
A、水泥 B、陶瓷 C、玻璃 D、塑料
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为______。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①pH<_________________的雨水称为酸雨;向煤中加入适量的__________________,可以大大减少燃物产物中SO2的量。
②天然水中杂质较多,常需加入明矾、ClO2等物质处理后才能饮用。加入ClO2的作用是
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y均为有刺激性气味的气体,且几种物质间有以下转化关系,部分产物未标出。请回答下列问题。

(1)写出下列各物质的化学式:X 、Y 、C 。
(2)反应①的化学方程式为 ,反应②的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com