
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca5F(PO4)3、Ca5(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。


部分物质的相关性质如下:
熔点/℃ | 沸点/℃ | 备注 | |
白磷 | 44 | 280.5 | |
PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 %。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为: 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是: (填化学式) ,冷凝塔1的主要沉积物是: 冷凝塔2的主要沉积物是:
(4)尾气中主要含有 ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 (均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是: 。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
在溶液中能大量共存的离子组是
A.Na+、OH一、HCO3- B.Ba2+、OH一、C1—
C.H+、K+、CO32- D.NH4+、NO3—、OH—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期末(理)化学试卷(解析版) 题型:填空题
将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:

(1)写出A→B段反应的离子方程式 。
(2)A点沉淀的总物质的量n= 。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积V2= mL。
(4)若V1=60mL ,则混合物中Mg的物质的量n(Mg)= ,V3点所加NaOH溶液的体积为V3=________mL。
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:填空题
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝
回答下列问题:
(1)A的化学式是 ,用电子式表示C的形成过程: 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:
(3)写出③的离子方程式
(4)简述D溶液呈碱性的理由
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上期末化学试卷(解析版) 题型:填空题
铁及其化合物有重要用途,如聚合硫酸铁[]是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
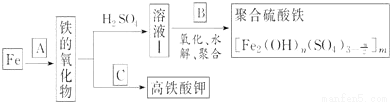
请回答下列问题:
(1)若A为H2O(g),写出反应方程式___________________________;
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-)_________________;
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
□Fe2O3+□KNO3+□KOH→□ ________ +□KNO2+□ ______
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol?L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 ; I2+2S2O32-═2I-+S4O42-
①滴定选用的指示剂及滴定终点观察到的现象__________________________;
②溶液Ⅰ中铁元素的总含量为__________ g?L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:选择题
分子式为C5H12O的醇催化氧化得到的有机物不能发生银镜反应的醇有( )
A.8种 B.7种 C.5种 D.3种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
下列试剂可用带磨口玻璃塞的玻璃试剂瓶保存的是( )
A.氢氟酸 B.硫酸 C.碳酸钠溶液 D.氧氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:填空题
氨气在生产、生活和科研中应用十分广泛 。
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47kJ/mol
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+72.49kJ/mol
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=_____________kJmol。
②液氨可以发生电离:2NH3(l) NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式______________。
(2)氨气易液化,便于储运,可利用NH3作储氢材料已知:2NH3(g) N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
N2(g)+3H2(g) ΔH=+92.4 kJ/mol 。
①氨气自发分解的反应条件是________________(填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度 的变化如图所示。
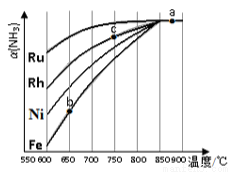
在600℃时催化效果最好的是________________(填催化剂的化学式)。c点氨气的转化率高于b点, 原因是________________。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式:________________。
②写出第二步反应的化学方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com