
 O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ① O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②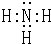 ;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;加热条件下,铵根离子和氢氧化钠反应生成氨气,氨气和水反应生成氨水,氨水溶液呈碱性,能使红色石蕊试纸变蓝色,所以检验铵根离子的方法是:取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.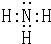 ;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子.
;取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子. Fe3O4+4H2↑.
Fe3O4+4H2↑. Fe3O4+4H2↑.
Fe3O4+4H2↑. O2(g)=ZO(s)△H=-272.0KJ.mol-1 ①
O2(g)=ZO(s)△H=-272.0KJ.mol-1 ① O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②
O2(g)=W2O3(s)△H=-1675.7KJ.mol-1②

科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| 1 |
| 202 |
| 3 |
| 202 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U203、W2O3、Z2O3。
回答下列问题:
(1)U的气态氢化物分子的电子式为____________________,盐A中阳离子的检验方法是_________________________;
(2) 元素V、W、X、Y的第一电离能的大小关系是:______________________,Z原子的最外层电子排布式__________;
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是_________;
(4)z单质与水在一定条件下反应的化学方程式为________________________;
(5)已知:Z(s)+1/2O2(g)=ZO(s) ![]()
W(s)+3/2O2(g)= W2O3(s) ![]()
W的单质和ZO反应的热化学方程式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com