
【题目】采用图1实验装置测定锌与稀硫酸反应的速率。
(1)检查图1装置气密性的操作方法是_____。
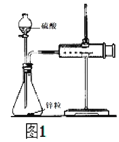
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者_____。(填“长”或“短”)
(3)同学们在实验操作中发现本实验设计存在明显不足,例如_____。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:_____。
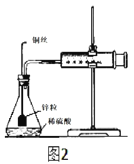
a.在多孔塑料袋中装入锌粒
b.在锥形瓶中加入40mL1mol/L硫酸
c.塞好橡胶塞,时立即用秒表计时
d.注射器内每增加5mL气体时读取一次秒表
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_____,反应进行一定时间后速率逐渐减慢,原因是_____。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是_____;在64s内用H+浓度表示的平均反应速率v(H+)=______(此时,溶液体积仍为40mL,气体摩尔体积25L/mol)。
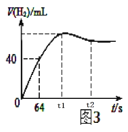
【答案】关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好 短 分液漏斗中溶液滴下占据体积引起气体体积读数误差或收集25mLH2时所需时间太短 多孔塑料袋浸入稀硫酸 反应放热,温度升高反应速率加快;酸中氢离子浓度减小 气体遇冷体积变小 v(H+)=0.00125mol/(L·s)
【解析】
(1)使装置内外形成气压差是气密性检查的常用手段检查该装置的气密性可关闭分液漏斗活塞,向外拉注射器的内管- -段距离后松手,若内管能回到开始位置证明气密性好,若不能则说明气密性不好;
(2) 1mol/L硫酸浓度小于4mol/L硫酸,化学反应速率后者快,收集25mL H2时所需时间后者比前者短;
(3)本实验设计存在明显不足,长颈漏斗的使用不能达到实验目的,应该改为分液漏斗,其次是反应速率太快,收集25mLH2时所需时间间隔太短,不易计时;
(4)产生一定体积的气体所需要的时间来确定反应速率时,在物质混合后就应该计时;
(5)观察到锌与稀硫酸反应初期,反应放热;温度升高,反应速率加快;反应进行一定时间后,酸中氢离子浓度减小,反应速率减慢;
(6)在金属锌和硫酸的反应中接近反应的最后阶段,因为气体的热胀冷缩性质,会发现气体的体积突然减小,根据金属锌和硫酸反应:Zn+2H+= Zn2++ H2↑,产生氢气40mL时,![]()
![]() ,
,![]() ,
,![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如下(部分反应条件已略去):
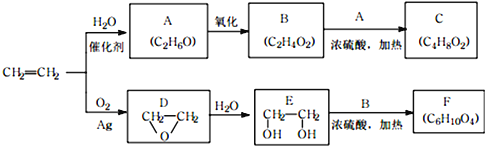
请回答下列问题:
(1)A的名称是___________,含有的官能团名称是_______________。
实验室由A转化为乙烯的反应条件为_______________。
(2)B和A反应生成C的化学方程式为_______________,该反应的类型为_______________。
(3)F的结构简式为__________________。
(4)写出D的同分异构体的结构简式__________________。
(5)乙炔是常见的一种化工原料,它可以制取很多化工产品。例如:聚氯乙烯塑料。写出由乙炔合成聚氯乙烯的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是 ( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种
D. 菲的结构简式为![]() ,它与硝酸反应,可生成 5种一硝基取代物
,它与硝酸反应,可生成 5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2![]() 4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
4NO+6H2O,下列为4种不同情况下测得的反应速率,表明该反应进行最快的是( )
A.v(NH3)=0.2mol/(L·s)B.v(O2)=10mol/(L·min)
C.v(H2O)=0.25mol/(L·s)D.v(NO)=8mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丙烯酸钠(![]() )具有超强吸水性,能吸收空气中的水分,可用于矿 山道路运输抑尘等。下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿 山道路运输抑尘等。下列叙述不正确的是( )
A. 聚丙烯酸钠属于纯净物 B. 聚丙烯酸钠可用于生产尿不湿
C. 聚丙烯酸钠的单体为CH2=CH—COONa D. 路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和 PM2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是
①乙二醇和丙三醇
②HCOOH与CH2=CH-COOH
③CH4与C3H8
④![]() CH3与
CH3与![]()
⑤CH![]() CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
A. ①④⑤ B. ①④⑥ C. ③ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸在接触室中发生的主要反应为2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
2SO3(g)。在一定温度下,向2L密闭容器内投入4molSO2(g)和2molO2(g)发生上述反应,n(SO2)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(SO2)(mol) | 4 | 3.2 | 1.6 | 1.4 | 1.4 |
(1)用SO3表示从0~2s内该反应的平均速率v(SO3)=___。
(2)该反应达到最大限度时SO2的转化率为___。
(提示:转化率=![]() ×100%)
×100%)
(3)该反应达到最大限度时O2的浓度为___。
(4)下列叙述能说明上述反应达到平衡状态的是___。
A.容器内压强保持不变
B.v(SO2)=2v(O2)
C.SO3的浓度不再变化
D.SO2、O2、SO3为浓度之比为2∶1∶2
E.单位时间内每消耗2molSO2,同时生成2molSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为熏蒸剂,分子结构与(CO2)相似。回答下列问题:
(1) 碳原子的核外电子排布式为____;组成羰基硫的元素中,半径最大的原子其核外有____种不同能量的电子。
(2)羰基硫为____(填“极性”或“非极性”)分子,羰基硫的电子式为____。
(3)解释稳定性 CO2 大于 CS2 的原因____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
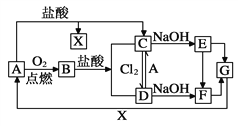
(1)写出A、C、F、G的化学式:A________,C_________,F_________,G_________。
(2)检验D中阳离子的方法_____________________________________________。
(3)保存C溶液时为什么要加固体A_____________________________________。
(4)写出下列转化的离子方程式C→D:____________________________________,由E转化为F的现象是 _________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com