
【题目】羰基硫(COS)可作为熏蒸剂,分子结构与(CO2)相似。回答下列问题:
(1) 碳原子的核外电子排布式为____;组成羰基硫的元素中,半径最大的原子其核外有____种不同能量的电子。
(2)羰基硫为____(填“极性”或“非极性”)分子,羰基硫的电子式为____。
(3)解释稳定性 CO2 大于 CS2 的原因____________________
【答案】1s22s22p2 5 极性 ![]() C=O 双键键能大于 C=S 双键键能,所以稳定性 CO2 大于 CS2。
C=O 双键键能大于 C=S 双键键能,所以稳定性 CO2 大于 CS2。
【解析】
(1) 碳原子的核外电子排布式为:1s22s22p2;电子层数越多,原子半径越大,电子层数相同的,原子序数越大,半径越小,则原子半径:S>C>O,则S原子的半径最大结合电子排布式1s22s22p63s23p4,同一轨道电子能量相同,则有5种能量不同的电子,
故答案为:1s22s22p2;5;
(2) 羰基硫中碳氧双键与碳硫双键的极性不同,所以羰基硫分子为极性分子;羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为![]() ;
;
故答案为:极性;![]() ;
;
(3) 解释稳定性CO2大于CS2的原因C=O双键键能大于C=S双键键能所以稳定性CO2大于CS2,
故答案为:C=O双键键能大于C=S双键键能所以稳定性CO2大于CS2。


科目:高中化学 来源: 题型:
【题目】芳香族化合物(C12H16O2)的性质有如下变化:
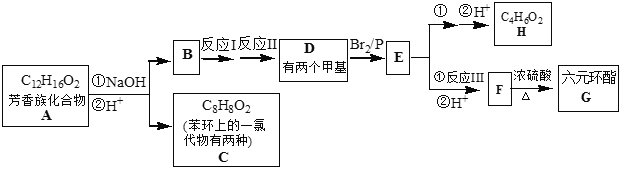
已知: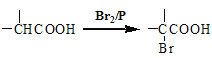
完成下列填空:
(1)E分子中所包含官能团的名称是____。
(2)D的结构简式:____。
(3)写出反应I所需的试剂和条件___;反应Ⅱ和反应Ⅲ的反应类型依次为:____、___;
(4)F生成G的化学方程式:____;
(5)已知M是C的同分异构体。M符合以下条件:
①苯环上有两个取代基(除苯环外无其他的环);②能发生水解反应③苯环上只有两种氢原子。
写出符合条件的M其中任意一种化合物的结构简式:____。
(6)运用中学化学知识及以上信息,写出由E合成 的的合成路线。__
的的合成路线。__
(合成路线常用的表示方式为:A![]() B
B![]() ……目标产物)
……目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用图1实验装置测定锌与稀硫酸反应的速率。
(1)检查图1装置气密性的操作方法是_____。
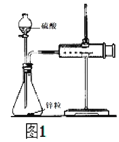
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者_____。(填“长”或“短”)
(3)同学们在实验操作中发现本实验设计存在明显不足,例如_____。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:_____。
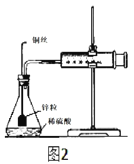
a.在多孔塑料袋中装入锌粒
b.在锥形瓶中加入40mL1mol/L硫酸
c.塞好橡胶塞,时立即用秒表计时
d.注射器内每增加5mL气体时读取一次秒表
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_____,反应进行一定时间后速率逐渐减慢,原因是_____。
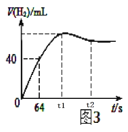
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是_____;在64s内用H+浓度表示的平均反应速率v(H+)=______(此时,溶液体积仍为40mL,气体摩尔体积25L/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究原电池产生电流的过程,设计了如图所示实验:
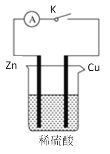
(1)下列叙述中正确的是___。
A.打开开关K时铜片作负极,关闭开关K时铜片作正极
B.打开开关K,锌片和铜片上均有气泡产生
C.关闭开关K后,溶液中的H+浓度减小
D.关闭开关K产生气泡的速率比打开开关K时慢
(2)打开开关K后,装置中发生反应的离子方程式为___。
(3)关闭开关K后,则该装置为___(填“原电池”或“电解池”),锌极为___极(填“正”、“负”、“阳”或“阴”),铜极上的电极反应式为__。若反应过程中有0.3mol的电子发生转移,则产生的气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图,请回答:
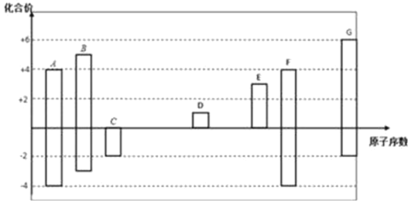
(1)元素F在周期表中的位置是___________________________。
(2)C2﹣、D+、G2﹣离子半径大小顺序是______________(用离子符号回答)。
(3)C和G的氢化物中,沸点较低的是______(填化学式),
因为____________________________________________。
(4)A与C形成化合物AC2的结构式为_______________,D的最高价氧化物的水化物的电子式为___________________。
(5)用电子式表示D与G元素形成化合物的过程______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示200℃时容器中各物质的量随时间的变化关系,图II表示平衡时平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
![]()
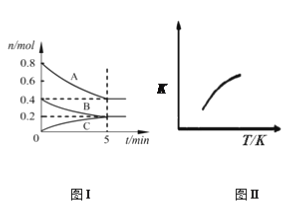
A. 200℃时,反应从开始到平衡的平均反应速率v(A)=0.08mol·L-1·min-1
B. 若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A + B ![]() C ΔH = +5m kJ/mol
C ΔH = +5m kJ/mol
C. 200℃时,若在第6 min再向体系中加入1molAr,A的转化率不变
D. 200℃时,平衡后再充入2 mol B和2 mol C时,v正>v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com