
| A. | 磷仅被还原 | B. | 磷既被氧化又被还原 | ||
| C. | 有$\frac{3}{4}$的磷被还原 | D. | 有$\frac{1}{2}$的磷被氧化 |
分析 4P+3KOH+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3KH2PO2+PH3↑中,P元素的化合价由0升高为+1,P元素的化合价由0降低为-3价,以此来解答.
解答 解:A.P元素失去电子也得到电子,则磷既被氧化又被还原,故A错误;
B.P元素失去电子也得到电子,则磷既被氧化又被还原,故B正确;
C.4molP中只有1molP被还原,故C错误;
D.4molP中只有3molP失去电子被氧化,故D错误;
故选B.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应基本概念,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )
有a、b、c、d四瓶不同物质的溶液,它们分别是Ba(OH)2溶液、Na2CO3溶液、MgCl2溶液和稀硫酸中的某一种(物质的量浓度均为0.2mol•L-1).为了鉴别以上物质,操作如下:各取少量溶液进行两两混合,实验现象如右表所示,表中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体,“-”表示观察不到明显现象.下列说法正确的是( )| A. | a是稀硫酸 | B. | b可能是Na2CO3溶液 | ||
| C. | c是Ba(OH)2溶液 | D. | d是MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
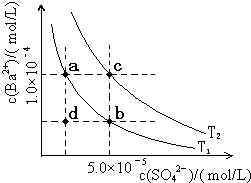 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
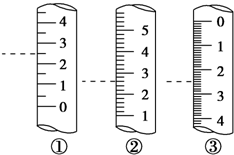 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不同 | |
| B. | 7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | |
| C. | 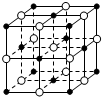 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元 | |
| D. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com