
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
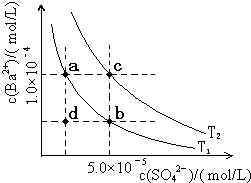 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:分析 (1)酸的电离平衡常数越大,该酸的酸性越强;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠;
(3)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,根据水解程度确定溶液的酸碱性;
(4)苯酚的电离平衡常数小于一水合氨,则苯酚铵为强碱弱酸盐,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨或苯酚铵和苯酚;
B.如果溶液呈酸性,溶液中的溶质为苯酚和苯酚铵;
C.含有弱根离子的盐促进水电离;
D.任何电解质溶液中都遵循物料守恒;
(5)①难溶物的溶解平衡是吸热过程,升高温度促进溶解;
②A.硫酸钠抑制硫酸钡电离;
B.在T1曲线上方区域(不含曲线)为过饱和溶液;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大.
解答 解:(1)根据表中数据知,酸的电离平衡常数大小顺序是①④③②,酸的电离平衡常数越大,其溶液酸性越强,所以这几种溶液的酸性强弱顺序是①④③②,
故答案为:①④③②;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠,离子方程式为:C6H5OH+PO43-=C6H5O-+HPO42-,
故答案为:C6H5OH+PO43-=C6H5O-+HPO42-;
(3)等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,醋酸根离子和铵根离子水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得c(CH3COO-)=c(NH4+),
故答案为:=;
(4)相同温度下,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨,苯酚和氨水的浓度相等,要使溶液呈碱性,苯酚的体积小于或等于或大于氨水体积都可能使混合溶液呈碱性,故A错误;
B.若混合液pH<7,溶液中的溶质为苯酚和苯酚铵,pH<7,则c(H+)>c(OH-),溶液中电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(C6H5O-)+c(OH-),所以c(C6H5O-)>c(NH4+),故B错误;
C.含有弱根离子的盐促进水电离,酸抑制水电离,所以苯酚铵促进水电离,苯酚抑制水电离,V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度,
,故C正确;
D.任何电解质溶液中都遵循物料守恒,根据物料守恒得V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH),故D正确;
故选CD,
故答案为:CD;
(5)①难溶物的溶解平衡是吸热过程,升高温度促进溶解,根据图知,T2温度下溶度积常数大于T1温度,所以T1<T2;
故答案为:<;
②A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故选ABC,
故答案为:ABC.
点评 本题考查弱电解质的电离及难溶物的溶解平衡等知识点,为高频考点,明确弱酸电离平衡常数与酸的强弱关系、难溶物溶解平衡图象含义是解本题关键,会利用物料守恒及电荷守恒确定离子浓度大小,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析实验中,须将滤纸上的试样点浸入展开剂中 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度不一定要比水大 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷仅被还原 | B. | 磷既被氧化又被还原 | ||
| C. | 有$\frac{3}{4}$的磷被还原 | D. | 有$\frac{1}{2}$的磷被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 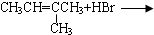 | B. | CH3CH2OH+O2$→_{△}^{Cu}$ | ||
| C. | CH4+Cl2 $\stackrel{光照}{→}$ | D. | nCH2=CH2$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢的质量是1 g | B. | 1 mol CO的质量为28 g•mol-1 | ||
| C. | 阿伏加德罗常数等于6.02×1023 | D. | 3.01×1023个SO2分子约是0.5 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com