
(12分)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: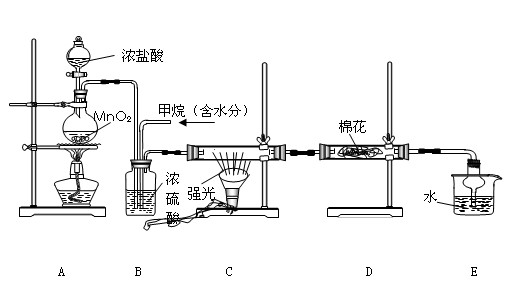
(1)写出A装置中发生反应的离子方程式
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≥
(4)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴![]() 有 溶液。
有 溶液。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式 。
(6) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 (填字母)。
![]() A.水洗分液法 B.蒸馏法 C.萃取分液法 D.结晶法
A.水洗分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(7) 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填字母)。
![]() A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| (1)可用改进汽油组成的办法来改善汽油的燃烧性能,例如,加入CH3OC(CH3)3来生产“无铅汽油”.CH3OC(CH3)3分子中必存在的原子间连接形式有 ③ ③ (填写编号、多选倒扣). |
| (2)天然气的燃烧产物无污染、热值高、管道输送方便,天然气将成为我国西部开发的重点之一.天然气常和石油伴生,其主要成分是 甲烷(或CH4) 甲烷(或CH4) .能说明它是正四面体而非正方形平面结构的理由是② ② (填写编号、多选倒扣). ①其一氯代物不存在同分异构体; ②其二氯代物不存在同分异构体; ③碳原子与氢原子之间以共价键结合; ④四个碳氢键是完全等价的. (3)1980年我国首次制成一辆燃氢汽车,乘员12 人,以50 km/h的速度行驶了40 km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下面可供开发又较经济的制氢方法是 ③ ③ (填写编号、多选倒扣). ①电解水;②锌和稀硫酸反应;③光解海水. 其次,制得氢气后还需要解决的问题是 氢气的输送和贮存 氢气的输送和贮存 (写出其中一个). |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)工来合成氨与制备硝酸一般可连续生产,流程如下:
(1)工来生产时,制取氢气的一个反应为:![]() ,
,
①t℃时,往l L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol?L-1,该温度下此反应的平衡常数K= ;
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率![]() (H2O)= 。
(H2O)= 。
T(K) | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)合成塔中发生反应为:
![]()
![]()
 右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
![]() 4NH3+5O2
4NH3+5O2![]() NO+6H2O AH=-905kJ?mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因 。
NO+6H2O AH=-905kJ?mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因 。
![]() (4)吸收塔中反应为:3NO2+H2O
(4)吸收塔中反应为:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
![]() (5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
![]() CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ![]() H=-574kJ?mol-1。;
H=-574kJ?mol-1。;
![]() CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ![]() H=-1160 kJ?mol-1;
H=-1160 kJ?mol-1;
则甲烷直接将NO2还原为N2的热化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com