

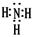 (2分) (2)第四周期第Ⅷ族(2分) 大于(2分)
(2分) (2)第四周期第Ⅷ族(2分) 大于(2分)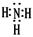 。
。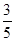 =6×10-6mol/L,Fe2+浓度是
=6×10-6mol/L,Fe2+浓度是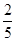 x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×
x,所以要有FeS沉淀产生,则c(Fe2+)·c(S2-) ≥Ksp=6×10-18 mol2·L-2,即6×10-6mol/L×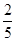 x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。
x≥6×10-18 mol2·L-2,解得x≥2.5×10-12 mol/L。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙、丙形成的化合物既有离子键又有共价键 |
| B.乙、丙、丁形成的氢化物常温下均为气体 |
| C.原子序数由小到大顺序为:甲<乙<丙<丁 |
| D.原子半径大小顺序为:丁>甲>乙>丙 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X、Y同主族,则Y原子半径大于X原子半径 |
| B.若X、Y同周期,则X、Y只能形成离子化合物 |
| C.若X为碳元素,则Y的气态氢化物的分子为非极性分子 |
| D.若X为铝元素,则Y最高价氧化物对应的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
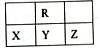
| A.Y的氢化物比Z的氢化物稳定 |
| B.原子半径大小顺序是X >Y>R |
| C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色 |
| D.四种元素中最高价氧化物的水化物的酸性最强的是Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. 14C与12C互为同素异形体 |
| B.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
| C.NOx、CO2、PM2.5颗粒都会导致酸雨 |
| D.避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子的还原性:Y2-> Z- |
| B.原子半径:r(W) > r(X) |
| C.质子数:c>a |
| D.W和X两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.R的单质能与W的氢化物反应,可证明非金属性:R>W |
| B.最高正价氧化物对应的水化物的酸性:R<W |
| C.X与Z组成的化合物是共价化合物,且又具有两性 |
| D.离子半径:Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com