
为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中。

请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有________个氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”,下同),打开___________________________________________________。
(3)当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________________。
(4)b中装的固体试剂是__________,请写出缓缓打开K1的理由__________。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到 y mL 气体,则过氧化钠的纯度是________(用含x、y的式子表示,上述体积均已折算成标准状况)。
答案 (1)2 1 (2)K1、K2 K3 (3)气球Q慢慢变小,气体进入量筒Ⅱ中 (4)碱石灰 控制气体的流速,使CO2被充分吸收 (5)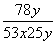 ×100%
×100%
解析 变质的Na2O2中可能含有碳酸钠,当样品与稀硫酸接触后发生反应:2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O、H2SO4+Na2CO3===Na2SO4+CO2↑+H2O,因而Q内产生O2与CO2 2种气体,其中的反应有1个为氧化还原反应。测定Na2O2的纯度,可通过直接测定CO2和O2的体积,然后经换算求出。将稀H2SO4加入气球前,关闭K1和K2,打开K3,反应结束时气球膨胀的体积与量筒Ⅰ中所接收的水的体积相等,此为CO2与O2的体积之和。待气球中反应完全后,关闭K3,打开K2,再缓缓打开K1,此时气球渐瘪,气体会经干燥管b进入量筒Ⅱ,CO2被干燥管中的吸收剂吸收,量筒Ⅱ中收集到气体的体积即为O2的体积。由题意可知,CO2和O2的总体积为x mL,O2的体积为y mL,故CO2的体积为(x-y) mL,可知Na2O2与Na2CO3的物质的量之比为2y∶(x-y),则Na2O2的纯度为w(Na2O2)=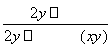 ×100%=
×100%=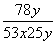 ×100%。
×100%。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)和甲醇(CH3OH)都是高效清洁能源。工业上利用煤的气化产物(水煤气)合成甲醇和二甲醚。回答下列问题:
(1)制备二甲醚最后一步反应由Al2O3催化甲醇脱水合成,反应方程式为 。
(2)已知:CO(g)+2H2(g)=CH3OH (g) △H= —90.1kJ·mol-1
CO(g)的燃烧热是282.8 kJ·mol-1;H2的燃烧热是285.8 kJ·mol-1
写出表示CH3OH (g) 燃烧热的热化学反应方程式 。
(3)二甲醚直接燃料电池比甲醇直接燃料电池更高效,等质量的二甲醚和甲醇完全放电转移电子的物质的量之比是 。用二甲醚直接燃料电池电解足量饱和食盐水,当消耗9.2g二甲醚时理论上阴极产生的气体的体积为 L。(标况下)
(4)在合成中伴有水煤气交换反应:CO(g)+H2O(g)  CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
CO2(g)+H2(g),等物质的量的CO(g)和H2O(g)加入密闭容器中反应,平衡时测得结果如下表。
| 温度 | 260℃ | 280℃ | 295℃ | 310℃ |
| CO转化率 | 89% | 80% | 75% | 60% |
①请解释CO转化率随温度变化的关系 。
②列式计算280℃时平衡常数 。
③若平衡体系中,测得H2的压强占总压的30%,要使体系中CO转化率达到70%,应该使温度 (填“升高”、“降低”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水)不能确定的物理量是________。
①1摩尔水的质量 ②1摩尔水蒸气的质量 ③1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.78 g苯含有C===C双键的数目为3NA
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将a g二氧化锰粉末加入c L b mol·L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.可以收集到氯气 L
L
B.反应后溶液中的Cl-数目为
C.NA可表示为
D.反应后溶液中的H+数目为bc-2d
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.图1验证苯中是否有碳碳双键
B.图2所示装置可分离CH3CH2OH和CCl4混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里用乙醇和浓硫酸反应生成乙烯,进而制取1,2-二溴乙烷。
(1)用下列仪器(短接口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
B经A(1)插入A中,D接A(2);A(3)接______接______接______接______。

(2)温度计水银球的正确位置是_______________________________。
(3)D与分液漏斗相比,其主要优点是________________________________。
(4)E装置烧杯中的冷水和反应管内液溴上的水层作用均是________________,
(5)若要准确测定乙烯的产量,下列方案可行的是_____________________。
方案I:将E及其后面的装置拆除后,连接图18—1所示装置进行实验,反应结束后,测其实验前后的质量,由此得到乙烯产量。
方案II:将E及其后面的装置拆除后,连接图18—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com