
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
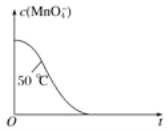
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水
【答案】![]() 2 2.5 ②③ ①② 0.010(或1.0×10-2)
2 2.5 ②③ ①② 0.010(或1.0×10-2) 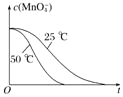 Mn2+对该化学反应起催化作用 B
Mn2+对该化学反应起催化作用 B
【解析】
(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的离子方程式;
H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同;
探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同;
(3)根据反应方程式及反应速率分式计算;
(4)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出曲线示意图;
(5)①由图3可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂;
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同。
(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;反应的离子方程式为![]() ;
;
H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥![]() =2.5;
=2.5;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;
探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;
(3)草酸的物质的量为:0.10molL-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010molL-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =
=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)= =0.010molL-1min-1;
=0.010molL-1min-1;
(4)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: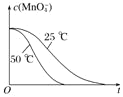 ;
;
(5)①由图3可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,故答案为:Mn2+对该化学反应起催化作用;
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,
答案选B。


科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

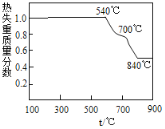
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
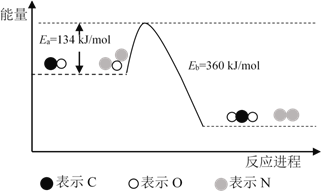
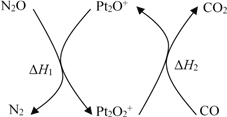
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的反应:2X(s)+Y(g)![]() 2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
2Z(g) △H小于0,为了使平衡向生成Z的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源.
(1)煤液化是_____(填“物理”或“化学”)变化过程。
(2)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:
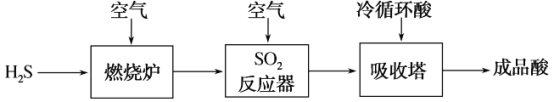
①SO2反应器中的化学方程式是_____。
②生产过程中的尾气需要测定SO2的含量符合标准才能排放.已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。尾气中SO2的含量(体积分数)的计算式是_____。
(3)H2S还可用于回收单质硫.含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫.FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图。
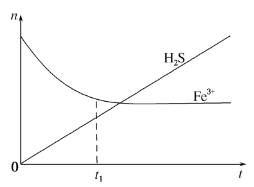
①由图中信息可知,0~t1时,一定发生的反应是_____(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)保持基本不变,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足可穿戴柔性电子设备(如二维手表带状柔性电池)的需求,我国科研团队研制出一种基于有机物电极材料芘四酮(PTO)和锌盐溶液作为电解液组装成的水系锌电池。原理如图所示。下列说法错误的是( )
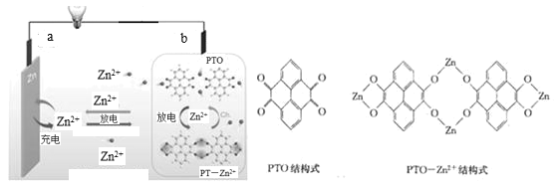
A.充电时,b接外接电源的负极
B.利用以上原理做成的柔性电池除优异的电化学性能外,还具备良好的弯曲性
C.充电时,每生成1molPTO,a电极增重260g
D.放电时,b极的电极反应式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com