
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

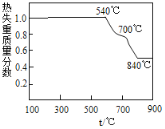
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
【答案】混合 700 增大反应物接触面积,加快反应速率 MgSO4+ 2NH3·H2O==Mg(OH)2↓+ (NH4)2SO4 (NH4)2SO4和NH3 减少能源消耗 便于碳酸钙分离
【解析】
(1)白云石属于混合物,碳酸镁分解生成氧化镁和二氧化碳;“研磨”的目的是增大反应物接触面积,加快反应速率;
(2)硫酸铵与氧化镁在加热条件下反应生成硫酸镁、氨气和水;根据流程图可以看出,氨气和硫酸铵能循环利用;
(3)采用轻烧白云石的方法制备氢氧化镁,能减少能源消耗、便于CaCO3分离。
(1)白云石属于混合物,碳酸镁分解生成氧化镁和二氧化碳,根据图2可以看出温度不能超过700℃;“研磨”的目的是增大反应物接触面积,加快反应速率;
(2)硫酸铵与氧化镁在加热条件下反应生成硫酸镁、氨气和水,则加入氨水时的化学方程式为MgSO4+ 2NH3·H2O=Mg(OH)2↓+ (NH4)2SO4;根据流程图可以看出,氨气和硫酸铵能循环利用,故整个流程中能循环利用的是(NH4)2SO4和NH3;
(3)采用轻烧白云石的方法制备氢氧化镁,能减少能源消耗、便于CaCO3分离。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中不是氧化还原反应的是( )
A.3Cl2+6KOH=5KCl+KClO3+3H2O
B.CuO+H2![]() Cu+H2O
Cu+H2O
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
(1)A的化学式是__________,B的化学式是________,C的化学式是__________。
(2)加入过量A的目的是__________________。
(3)加入过量B的目的是____________________。
(4)加热煮沸的目的是________________________。
(5)操作Ⅰ的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 按系统命名法, ![]() 的名称为2,6二甲基5乙基庚烷
的名称为2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脱水,最多可生成4种二肽
C. 化合物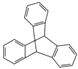 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是生产、生活、实验中常用的试剂。
I.工业上制备H2O2的流程如下:
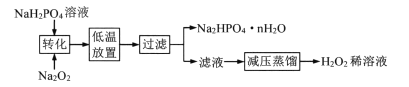
(1)“转化”中反应的化学方程式为_________:“低温放置”的目的是_________
(2)图甲为“减压蒸馏”的部分装置,该装置由克氏蒸馏头和_________(填仪器名称)组成。
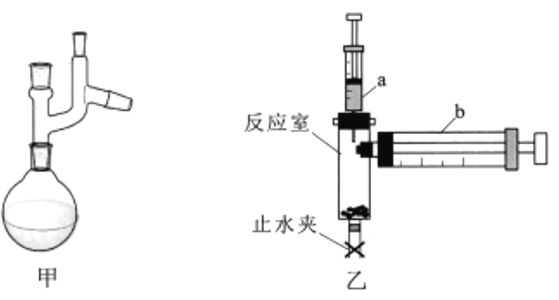
lI.实验小组利用图乙装置测定阿伏加德罗常数(NA)
(3)实验准备
①H2O2溶液浓度标定。可选用_________(填标号)试剂对H2O2溶液进行滴定,测定其浓度。
A.H2C2O4B.KMnO4C.淀粉KI
②装置气密性检查。打开止水夹,将注射器b的活塞推至底部,拉动注射器a活塞吸入10mL空气,关闭止水夹。向下推动注射器a活塞至底,当观察到注射器b的现象为_________,说明装置的气密性良好。
(4)测定过程
①在反应室中加入适量MnO2,将注射器b活塞推至底部,关闭止水夹。用注射器a准确抽取cmol/LH2O2溶液VlmL,缓慢地注入反应室后,固定注射器a活塞。
②反应结束后,待反应体系处于_________状态时,读取注射器b的气体体积为V2mL,则产生O2的体积为____mL。
③设室温下O2的密度为ρg/L,一个O2实际质量为mg,则NA=____(用含ρ等字母的代数式表示)。
(5)该实验利用H2O2作为生氧剂的优点有_________(写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量的硫酸溶液中加入200mL 0.4mol/L 的Ba(OH)2溶液,放出10.24kJ的热量。向足量的Ba(OH)2溶液中加入200mL 0.4mol/L 的HCl溶液,放出2.2kJ的热量。则硫酸钠溶液和氯化钡溶液反应的离子的热化学方程式为
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -2.92 kJ/mol
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -18 kJ/mol
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -0.72 kJ/mol
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H = -73 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
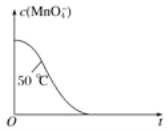
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com