
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
【答案】D
【解析】
A.Cr的原子序数为24,价电子排布为3d54s1,基态Cr原子有6个未成对电子,A正确;
B.PH3分子结构和NH3相似,中心原子都含有一个孤电子对,N元素的电负性大于P,电负性越大,其原子越不易提供孤电子对,故PH3提供孤电子对的能力强于NH3,B正确;
C.BeO的晶格能大于MgO,说明Be2+离子结合碳酸根中的氧离子的能力更强,故BeCO3更容易分解生成氧化物和二氧化碳,所以BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3,C正确;
D.内界配体Cl-不与Ag+反应,外界Cl-离子与Ag+反应,在向1mol该配合物中加入足量AgNO3溶液,可以得到2molAgCl沉淀,D错误。
答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

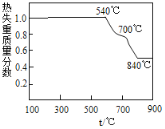
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是( )
A.铝片放入NaOH溶液中有气体产生:2Al+2OH﹣+2H2O=2AlO2+3H2↑
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72(橙色)+H2O2CrO42(黄色)+2H+
C.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32- +CO2+H2O=H2SiO3(胶体)+ CO32-
D.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4+CO32-![]() CaCO3+SO42-
CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源.
(1)煤液化是_____(填“物理”或“化学”)变化过程。
(2)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:
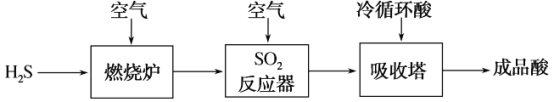
①SO2反应器中的化学方程式是_____。
②生产过程中的尾气需要测定SO2的含量符合标准才能排放.已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。尾气中SO2的含量(体积分数)的计算式是_____。
(3)H2S还可用于回收单质硫.含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫.FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图。
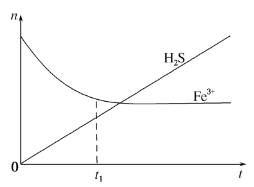
①由图中信息可知,0~t1时,一定发生的反应是_____(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)保持基本不变,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=_______。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=____________。
(4)原混合气体中a : b=_______________。
(5)达到平衡时,N2和H2的转化率![]() (N2):
(N2):![]() (H2)=______________。
(H2)=______________。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产。
(1)起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为________。
1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出HCl气体,该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备。
(2)1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为________(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
(3)“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是对“索尔维制碱法”的改进,将氨碱法制取碳酸钠与合成氨联合起来,大大提高了食盐的利用率,缩短了生产流程,减少了对环境的污染,至今仍为全世界广泛采用。
用如图所示装置可以模拟“加热碳酸氢钠制得纯碱”的过程。

当观察到B中出现浑浊时,停止加热,A中发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )
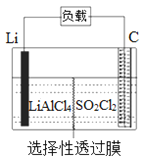
A. 电池工作时负极材料是Li,发生氧化反应
B. 电池工作时电子流向:锂电极→导线→负载→碳棒
C. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
D. 电池工作时,外电路流过0.2 mol电子,生成2.24 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足可穿戴柔性电子设备(如二维手表带状柔性电池)的需求,我国科研团队研制出一种基于有机物电极材料芘四酮(PTO)和锌盐溶液作为电解液组装成的水系锌电池。原理如图所示。下列说法错误的是( )
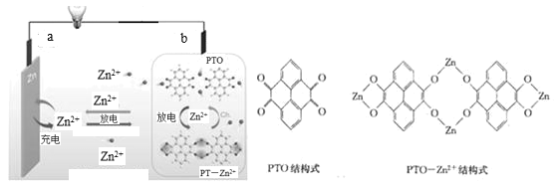
A.充电时,b接外接电源的负极
B.利用以上原理做成的柔性电池除优异的电化学性能外,还具备良好的弯曲性
C.充电时,每生成1molPTO,a电极增重260g
D.放电时,b极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
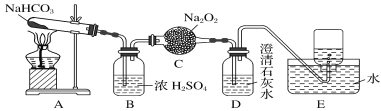
(1) D装置的作用是________,E中收集的气体是___________ (填名称)。
(2) 浓硫酸的作用是 _____________。
(3) A中发生反应的化学方程式为____________。
(4) C中发生反应的化学方程式为_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com