
【题目】H2O2是生产、生活、实验中常用的试剂。
I.工业上制备H2O2的流程如下:
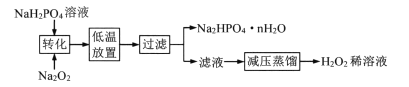
(1)“转化”中反应的化学方程式为_________:“低温放置”的目的是_________
(2)图甲为“减压蒸馏”的部分装置,该装置由克氏蒸馏头和_________(填仪器名称)组成。
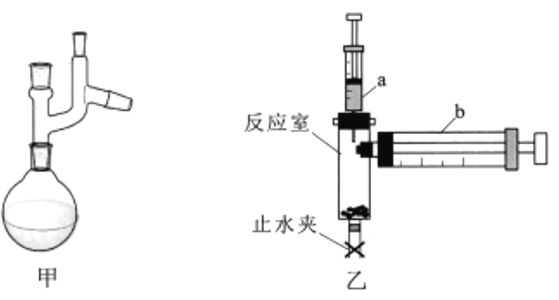
lI.实验小组利用图乙装置测定阿伏加德罗常数(NA)
(3)实验准备
①H2O2溶液浓度标定。可选用_________(填标号)试剂对H2O2溶液进行滴定,测定其浓度。
A.H2C2O4B.KMnO4C.淀粉KI
②装置气密性检查。打开止水夹,将注射器b的活塞推至底部,拉动注射器a活塞吸入10mL空气,关闭止水夹。向下推动注射器a活塞至底,当观察到注射器b的现象为_________,说明装置的气密性良好。
(4)测定过程
①在反应室中加入适量MnO2,将注射器b活塞推至底部,关闭止水夹。用注射器a准确抽取cmol/LH2O2溶液VlmL,缓慢地注入反应室后,固定注射器a活塞。
②反应结束后,待反应体系处于_________状态时,读取注射器b的气体体积为V2mL,则产生O2的体积为____mL。
③设室温下O2的密度为ρg/L,一个O2实际质量为mg,则NA=____(用含ρ等字母的代数式表示)。
(5)该实验利用H2O2作为生氧剂的优点有_________(写两条)。
【答案】Na2O2+2NaH2PO4=2Na2HPO4+H2O2 防止H2O2受热分解,沉降Na2HPO4·nH2O固体 圆底烧瓶 B 注射器b的活塞向右移动,且最终注射器b中的气体体积为10mL 恢复室温或体积不再改变或压强不再改变 V2-V1 ![]() 反应完全、无污染、反应速率快等合理答案均可
反应完全、无污染、反应速率快等合理答案均可
【解析】
由反应流程可知转化方程式为Na2O2+2NaH2PO4=2Na2HPO4+H2O2,H2O2 受热易分解为水和氧气,故应低温放置;
H2O2具有还原性,与KMnO4反应现象明显,可以利用溶液颜色变化来测定H2O2溶液浓度,
由分析可知:
(1)转化中方程式为Na2O2+2NaH2PO4=2Na2HPO4+H2O2,低温放置目的在于防止H2O2受热分解,沉降Na2HPO4·nH2O固体;
(2)由装置图可知反应中的仪器为圆底烧瓶;
(3)①由H2O2的还原性,以及溶液颜色的变化作为实验结束标志可知选用KMnO4溶液测量结果更精确,故选B;
②注射器b的活塞向右移动,且最终注射器b中的气体体积为10mL
(4)①测量气体体积时应避免温度对气体体积的影响,准确测量气体体积应在室温下,故答案为:恢复室温或体积不再改变或压强不再改变;
②注射器中气体体积的变化是由于H2O2的分解产生的O2引起的,故氧气的体积为V2-V1 mL;
③由题中信息可知生成的![]() 的质量m(O2)=ρg/L
的质量m(O2)=ρg/L![]() L,由
L,由![]() 可知:
可知:![]() ;故可得m(O2)=
;故可得m(O2)=![]() 所以结合式子可得NA=
所以结合式子可得NA=![]() ;
;
(5)![]() 作为自身具有氧化性,反应产物为水和氧气,故本实验的优点是反应完全、无污染、反应速率快等。
作为自身具有氧化性,反应产物为水和氧气,故本实验的优点是反应完全、无污染、反应速率快等。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
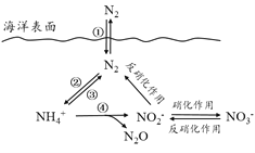
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,下列说法不正确的是
A. 已知分子式为C5H12O的醇有8种,则分子式为C6H12O2的羧酸也有8种
B. 已知分子式为C7H14O的酮有15种,则分子式为C7H14O2的酯也有15种
C. 已知丙烷的一氯一溴代物有5种,则分子式为C4H9NO2的氨基酸也有5种
D. 已知金刚烷( )的二氯代物有6种,则金刚烷的十四氯代物也有6种
)的二氯代物有6种,则金刚烷的十四氯代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

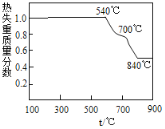
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO- ![]() 2CO2↑ + CO32 + 3Cl- + N2↑
2CO2↑ + CO32 + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
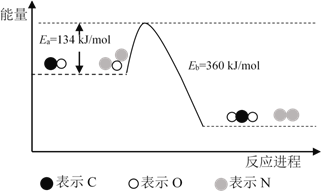
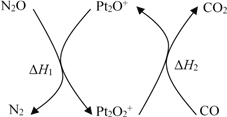
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)![]() CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是一种重要的化工原料,广泛应用于玻璃、造纸、纺织和洗涤剂的生产。
(1)起初,人们从盐碱地和盐湖中获得纯碱,但远远不能满足工业发展的需要,纯碱的化学式为________。
1791年,“路布兰制碱法”取得专利。该方法以硫酸、氯化钠、木炭、白垩石(主要成分为碳酸钙)为原料,但在20世纪20年代后被淘汰,因为生产过程中释放出HCl气体,该气体遇空气中的水蒸气易形成酸雾,腐蚀金属设备。
(2)1861年,“索尔维制碱法”问世,该方法是在用氯化钠溶液吸收两种工业废气时意外发现的,反应后生成碳酸氢钠和氯化铵(NH4Cl),再加热碳酸氢钠即可制得纯碱,氯化钠溶液吸收的两种气体为________(填字母)。
A.Cl2 B.NH3 C.SO2 D.CO2
(3)“侯氏制碱法”由我国化学工程专家侯德榜先生于1943年创立,是对“索尔维制碱法”的改进,将氨碱法制取碳酸钠与合成氨联合起来,大大提高了食盐的利用率,缩短了生产流程,减少了对环境的污染,至今仍为全世界广泛采用。
用如图所示装置可以模拟“加热碳酸氢钠制得纯碱”的过程。

当观察到B中出现浑浊时,停止加热,A中发生反应的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com