
【题目】某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: __________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式:____________________________________。
(2)“转化”时加入NaOH的主要作用是________________________(用离子方程式表示)。
(3)上述工艺中可以循环利用的主要物质是________________、_________________和水。
【答案】CaCO3+SiO2![]() CaSiO3+CO2↑ Na2CO3+Al2O3
CaSiO3+CO2↑ Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ HCO3-+OH-===H2O+CO32- Na2CO3 CO2
2NaAlO2+CO2↑ HCO3-+OH-===H2O+CO32- Na2CO3 CO2
【解析】
难溶性钾长石(K2OAl2O36SiO2)为原料加入碳酸钙,碳酸钠高温煅烧后加入水浸取得到浸出渣为硅酸钙,浸取液为偏铝酸钠溶液,通入过量二氧化碳气体生成氢氧化铝沉淀过滤得到固体氢氧化铝.灼烧分解生成氧化铝;滤液主要是碳酸氢钠溶液,加入氢氧化钠溶液反应生成碳酸钠;
(1)①碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳;
②氧化铝和碳酸钠在高温下反应生成偏铝酸钠和二氧化碳;
(2)碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水;
(3)根据流程图推测可以循环利用的主要物质.
(1)①碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2![]() CaSiO3+CO2↑;
CaSiO3+CO2↑;
②氧化铝和碳酸钠在高温下反应生成偏铝酸钠和二氧化碳,Al2O3+Na2CO3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(2)碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,离子反应方程式为HCO3-+OH-=CO32-+H2O;
(3)煅烧时需要碳酸钠,在流程图提取碳酸钾之前可得到碳酸钠,所以碳酸钠为可循环利用的物质,在浸出液中需通二氧化碳,而碳酸钙与二氧化硅、氧化铝和碳酸钠在高温下反应都有二氧化碳生成,所以,二氧化碳是可循环使用的物质。


科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. CaO+H2O=Ca(OH)2 B. 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C. SO2+H2O2=H2SO4 D. Cu(OH)2![]() CuO+H2O
CuO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量_________途径Ⅱ放出的热量。(填“>”、“=”或“<”)
(2)用ΔH2、ΔH3、ΔH4表示ΔH1的数学关系式是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
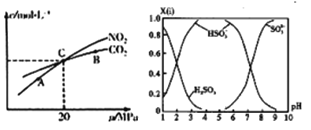
②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是______(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:a.称取0.5000 g样品,放入盛有 20 mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;b.待样品溶解后,加水50 mL;c.立即用0.2000 mol·L-1 Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积; d.重复步骤a至c 2次,记录消耗标准溶液的平均体积为25.00 mL。
已知:CuCl + Fe3+ = Cu2+ + Fe2+ + Cl- Fe2+ + Ce4+ = Fe3+ + Ce3+
①配制100 mL 0.2000 mol·L-1 的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、100 mL容量瓶外,还需要_______。
②通过计算确定该样品中CuCl的纯度。______
③进行步骤c时若操作缓慢,则测得CuCl的纯度_______(“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是

A.该过程中可得到化工产品H2SO4
B.该工艺流程是除去煤燃烧时产生的SO2
C.该过程中化合价发生改变的元素为Fe和S
D.图中涉及到的反应之一为Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀硝酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与稀HNO3反应制取NO的化学方程式并用双线桥标明电子的转移方向及数目_________________
(2)64gCu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗的HNO3的物质的量是_________(填字母代号)。
A.0.5mol B. 1.0mol C. 2.0mol D. 3.0mol
产生的气体分别是_______________,其物质的量之比是_______________
(3)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。___HNO3+_______→ _______+ _______ +___ NO↑+___H2O
(4)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是_______(填字母代号)。
A.Cu![]() Cu(NO3)2
Cu(NO3)2
B.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法 一定正确的是( )

A. 一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42﹣、Fe3+
B. 一定存在H+、Al3+、NH4+、SO42﹣,可能存在Na+、Mg2+
C. 溶液中c(H+):c(Al3+):c(Mg2+)为1:1:2
D. 溶液中c(H+)/c(SO42﹣)比值小于等于2/9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com