
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
【答案】A
【解析】A.根据NaHC2O4溶液中的物料守恒得c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),根据电荷守恒可得:c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),二者结合可得:c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-),则c(H+)=c(C2O42-)+c(OH-)-c(H2C2O4),所以c(H+)>c(C2O42-)-c(H2C2O4),故A正确;B.根据图象可知,c(HC2O4ˉ)>amolL-1时, c(C2O42-)>c(H2C2O4),则HC2O4ˉ的水解程度小于电离程度,故B错误;
C.由图可知,c(HC2O4ˉ)=amol/L时c(H+)=c(H2C2O4),草酸的电离平衡常数为:![]() =c(HC2O4ˉ)=a,Ka(HC2O4ˉ)=
=c(HC2O4ˉ)=a,Ka(HC2O4ˉ)=![]() ,草酸的第二步电离小于第一步电离,则Ka(HC2O4ˉ)<a,故C错误;
,草酸的第二步电离小于第一步电离,则Ka(HC2O4ˉ)<a,故C错误;
D.将0.08molLˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),反应后溶质为0.04mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4),正确的离子浓度大小为:c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H+)>c(H2C2O4)>c(OH-),故D错误;故选A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C. 将0.2 mol FeCl3制成胶体,所得胶体粒子数为0.2NA
D. 50 mL12 mol/L盐酸与足量Fe反应,转移电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A. 1mol NH3所含有的原子数为NA
B. 常温常压下,22.4L氧气所含的原子数为2NA
C. 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
D. 1 L 0.1mol/LNaCl溶液中所含的Na+ 为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)已知4.5g的X气体中所含分子数约为9.03×1022,则该气体的摩尔质量为___________,标准状况下体积为_______________。
(2)标准状况下,由CO和CO2组成的6.72L混合气体的质量为9.6g。此混合物中CO和CO2的物质的量之比为_________,该混合气体的密度是相同状况下氢气密度的___________倍。

(3)某微粒的结构示意图如图所示,当x-y < 10时,该微粒是______________ (选填“阳离子”或“阴离子”或“原子”) ;当y=1的中性原子M跟y=6的中性原子N化合时,形成化合物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。(提示:无水硫酸铜遇水变蓝;氯气易溶于CCl4等有机溶剂)
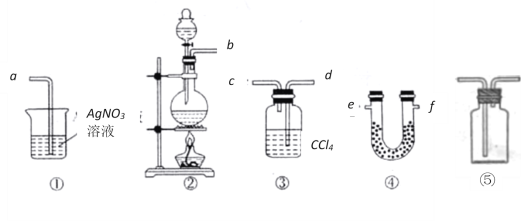
(1)根据甲同学的意图,连接相应的装置,接口顺序为:b接___,____接_____,____接a。
(2)在连接好装置之后实验开始之前必须要进行的一项操作是:___________________。
(3)U形管中所盛试剂的化学式为___________;装置③中CCl4的作用是____________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之
间再加装置⑤,你认为装置⑤应加在__________________之间(填装置序号),瓶中可以放入_________________________________。
(5)若在装置完好的前提下,用浓度为10mol/L的浓盐酸600mL与过量的的MnO2反应,最终生成的氯气_____1.5mol(填大于、小于或等于),其主要原因是___________________________,可以通过向反应后的溶液中加入___________来证明上述结论。
A.锌粒 B.氢氧化钠溶液 C.硝酸酸化的硝酸银溶液 D.碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A. 2.3gNa在足量的氧气中充分燃烧,转移的电子数为0.2NA
B. 标准状况下,22.4 L水中含有的氧原子数为NA
C. 1L 0.5molL﹣1的AlCl3溶液中所含Cl数目为3NA
D. 0.1 mol 氯气所含有的原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误是的( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.双原子单质分子中含有的共价键一定非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。
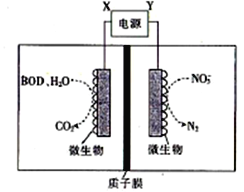
下列说法错误的是
A. X为电源正极
B. 若该装置在高温下进行,则净化效率将降低
C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole-
D. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 molL-1的NaOH溶液240 mL,根据溶液的配制情况回答下列问题:
(1)实验中除了用到托盘天平、药匙、量筒、烧杯外,还需用到的仪器有________。
(2)通过计算可知,该实验需要称量NaOH_____g;某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示,则烧杯的实际质量为___g。
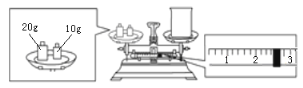
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,下列操作会使溶液浓度偏大的是_____(填序号)。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com