
【题目】实验室欲用NaOH固体配制1.0 molL-1的NaOH溶液240 mL,根据溶液的配制情况回答下列问题:
(1)实验中除了用到托盘天平、药匙、量筒、烧杯外,还需用到的仪器有________。
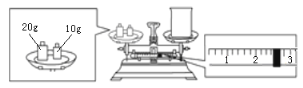
(2)通过计算可知,该实验需要称量NaOH_____g;某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示,则烧杯的实际质量为___g。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,下列操作会使溶液浓度偏大的是_____(填序号)。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】玻璃棒、250mL容量瓶、胶头滴管 10.0 27.4 检查容量瓶是否漏水 BC
【解析】
(1)根据实验操作的步骤以及每步操作需要仪器确定实验所需仪器;
(2)根据天平的称量原理;根据m=nM=cVM计算溶质NaOH的质量;
(3)使用容量瓶前必须进行的一步操作是检漏;
(4)根据c=n/V分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:玻璃棒、250mL容量瓶、胶头滴管;
(2)因配制溶液的体积为240ml,而容量瓶的规格没有240mL,只能选用250mL,NaOH的质量m=cVM=1.0molL-1×0.25L×40g/mol=10.0g,因天平的称量原理为左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为27.4g,故答案为:10.0;27.4;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,故答案为:检查容量瓶是否漏水;
(4)A项、转移溶液时不慎有少量洒到容量瓶外面,溶质的质量减少,浓度偏小,故A错误;B项、定容时俯视刻度线,溶液的体积偏小,浓度偏高,故B正确;C项、未冷却到室温就将溶液转移到容量瓶并定容,冷却下来溶液的体积偏小,浓度偏高,故C正确;D项、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液的体积偏大,浓度偏小,故D错误,故选BC,故答案为:BC。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌粒与稀硫酸的反应
B.水分解生成氢气和氧气
C.甲烷在空气中燃烧的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入 Cu(NO3)2 固体,铜粉可以溶解
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C.浓硝酸性质稳定,见光也不易分解
D.HNO3→NO→NO2,以上各步变化均能通过一步实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.氢氧燃料电池可把化学能转化为电能
C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示)
(1)写山F的基态原子的核外电子排布式:______________。
(2)Y、Z、W的电负性由大到小的顺序为_____________。
(3)以下可以表示X的基态原子的原子轨道表示式的是____________。
A. ![]() B.
B. ![]() C.
C. ![]()
(4)下图可以表示F的氢化物中电子云重叠方式的是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)基态E原子核外存在_____种运动状态不同的电子。
(6)G元素位于周期表中的_____区,基态原子价电子排布式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: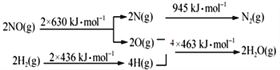
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
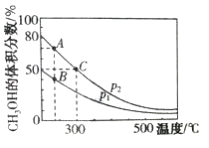
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
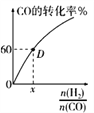
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
2SO3(g) ΔH = a kJ/mol,能量变化如图所示。下列说法中,不正确的是( )
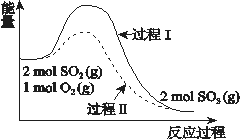
A. 2SO2(g) + O2(g) ![]() 2SO3(l) ΔH > a kJ/mol
2SO3(l) ΔH > a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molSO2(g) 和1mol O2(g)置于一密闭容器中充分反应后放出或吸收的热量小于┃a┃ kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com